
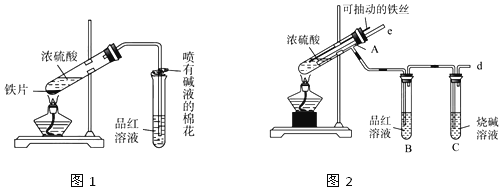
分析 (1)图2装置中Fe丝可以抽动,能控制反应的发生和停止,有尾气处理装置;
(2)导气管e与外界连通能起到平衡压强防止倒吸的作用;根据检验二氧化硫的方法分析;
(3)验证Ⅱ:检验Fe2+,先加KSCN溶液,再加H2O2溶液;
验证Ⅲ:步骤1.检验Fe3+,加KSCN溶液,变红色;或加淀粉KI溶液,变蓝色;
步骤2.既有Fe3+又有Fe2+时,检验Fe2+要加酸性KMnO4溶液.
解答 解:(1)图2装置中Fe丝可以抽动,能控制反应的发生和停止,而且有尾气处理装置,
故答案为:便于控制反应的发生和停止;
(2)导气管e与外界连通能起到平衡压强防止倒吸的作用;二氧化硫具有漂白性,能是品红溶液褪色,
故答案为:停止加热时,能防止倒吸或平衡压强;品红溶液褪色;
(3)验证Ⅱ:检验Fe2+,先加KSCN溶液,再加H2O2溶液;
故答案为:C,G;
验证Ⅲ:步骤1.检验Fe3+,加KSCN溶液,变红色,发生的反应为:Fe3++3SCN-═Fe(SCN)3;或加淀粉KI溶液,变蓝色,其反应为:2I-+2Fe3+=I2+2Fe2+;
故答案为:C(或F);红(或蓝);Fe3++3SCN-═Fe(SCN)3或2I-+2Fe3+=I2+2Fe2+;
步骤2.既有Fe3+又有Fe2+时,检验Fe2+要加酸性KMnO4溶液,高锰酸钾溶液褪色证明有二价铁离子,
故答案为:D;酸性KMnO4溶液的浅红色褪去.
点评 本题考查性质方案的设计,题目难度中等,明确常见元素及其化合物性质为解答关键,注意掌握性质方案设计的原则,试题培养了学生的分析能力及化学实验能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
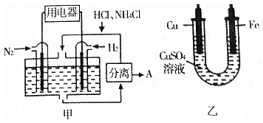 如图甲是一种既能提供电能,又能实现氮固定的新型燃料电池(采用新型电极材料,N2、H2为电极反应物,HCl-NH4Cl为电解质溶液);图乙是利用甲装置产生的电能在铁上镀铜.
如图甲是一种既能提供电能,又能实现氮固定的新型燃料电池(采用新型电极材料,N2、H2为电极反应物,HCl-NH4Cl为电解质溶液);图乙是利用甲装置产生的电能在铁上镀铜.| A. | 通入H2-极与图乙中的铜电极相连 | |
| B. | 电池工作一段时间后,溶液pH减少1 | |
| C. | 当消耗0.025molN2时,则铁电极增重1.6g | |
| D. | 通入N2-端的电极反应式为:N2+8H++6e-═2NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部 | B. | 除①④⑥以外 | C. | ③④⑤⑥ | D. | ②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuO | B. | MnO2 | C. | Fe2O3 | D. | Fe3O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 原子序数 | 原子的价电子排布式 | 周期 | 族 |
| 17 | 第三 | ||
| 3d54s1 | ⅥB |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾既可用作净水剂,也可用作消毒剂 | |
| B. | 小苏打、氢氧化铝都可用于治疗胃酸过多 | |
| C. | 煤的干馏、石油的分馏都属于化学变化 | |
| D. | 已知PM2.5是指大气中直径小于或等于2.5微米(1微米=1000纳米)的颗粒物,则PM2.5在空气中能形成胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
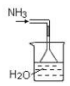 | 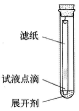 | 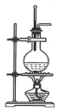 | 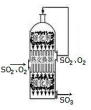 |
| A.吸收多余氨气 | B.Fe3+、Cu2+的分离 | C.酒精和浓硫酸制取乙烯 | D.充分利用反应中的能量 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com