
| A. | 由一种元素组成的物质一定是单质 | |
| B. | 凡是能电离出H+的化合物都是酸 | |
| C. | 碱能电离出OH-而使溶液显碱性,但溶液显碱性的不一定是碱 | |
| D. | 氨溶于水形成的溶液能导电,所以氨是电解质 |
分析 A.单质是一种元素组成的纯净物;
B.水溶液中电离出的阳离子全部是氢离子的化合物;
C.水溶液中电离出的阴离子全部是氢氧根离子的化合物为碱,盐溶液中弱酸阴离子水解溶液线碱性;
D.水溶液中或熔融状态下导电的化合物为电解质.
解答 解:A、氧气和臭氧组成的混合物由一种元素组成,不是单质,故A错误;
B.电离出阳离子全部是H+的化合物都是酸,酸式盐电离也会电离出氢离子,如NaHSO4,故B错误;
C.碱能电离出OH-而使溶液显碱性,但溶液显碱性的不一定是碱,也可以是盐,故C正确;
D.氨溶于水形成的溶液能导电,是因为氨气和水反应生成了电解质一水合氨,氨气本身不能电离,所以氨是非电解质,故D错误;
故选C.
点评 本题考查了物质分类、酸碱盐概念的实质理解应用,掌握基础是解题关键,题目难度不大.


科目:高中化学 来源: 题型:填空题
| 序号 | 锥形瓶中溶液 | 滴定管中溶液 | 选用指示剂 |  选用滴定管 |
| A | 碱 | 酸 | 石芯 | (乙) |
| B | 酸 | 碱 | 酚酞 | (甲) |
| C | 碱 | 酸 | 甲基橙 | (甲) |
| D | 酸 | 碱 | 酚酞 | (乙) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解过程中共转移0.4 mol电子 | B. | 原混合液中c(K+)为2.0 mol•L-l | ||
| C. | 电解得到的Cu的质量为6.4 g | D. | 电解后溶液中c(H+)为0.1 mol•L-l |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PbO2为还原剂,具有还原性 | |
| B. | 氧化产物与还原产物的物质的量之比为5:2 | |
| C. | 生成1mol的Pb2+,转移的电子的物质的量为2mol | |
| D. | 酸性环境下MnO4-具有强氧化性,其氧化性强于PbO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NA个H2与O2恰好反应,消耗氧气的体积约是22.4L | |
| B. | 1molC12与足量Fe反应,转移的电子数为3NA | |
| C. | 0.1molNaHSO4固体中,共含有0.2 NA个离子 | |
| D. | 在标准状况下,lLpH=13的NaOH溶液中,含有0.1NA个OH-(不考虑水的电离) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
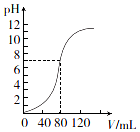 用1.0mol•L-l NaOH溶液中和某浓度H2SO4溶液时,其pH和所加NaOH溶液的体积(V)关系如图所示.则原硫酸溶液的物质的量浓度和恰好中和时溶液的总体积分别是(假设混合后溶液总体积为二者体积之和)( )
用1.0mol•L-l NaOH溶液中和某浓度H2SO4溶液时,其pH和所加NaOH溶液的体积(V)关系如图所示.则原硫酸溶液的物质的量浓度和恰好中和时溶液的总体积分别是(假设混合后溶液总体积为二者体积之和)( )| A. | 0.5 mol•L-1、160 mL | B. | 1.0 mol•L-1、160 mL | ||
| C. | 0.5 mol•L-1、80 ml | D. | 1.0 mol•L-1、80 ml |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
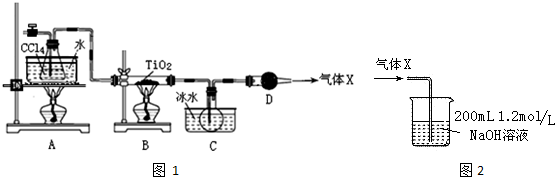
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76.8 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
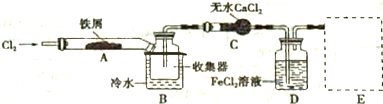

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com