
| A、N2、H2、NH3的百分含量相等 |
| B、3v(N2)正=v(H2)逆 |
| C、定容容器中,气体的密度不变 |
| D、N2、H2、NH3的浓度之比为1:3:2 |
| 总质量 |
| 体积 |


科目:高中化学 来源: 题型:
 磷酸(H3PO4)在水溶液中各种存在形式物质的量分数δ随pH的变化曲线如图:
磷酸(H3PO4)在水溶液中各种存在形式物质的量分数δ随pH的变化曲线如图:| c(Na+) |
| c(PO43-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、③④ | C、②③ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在纸上层析操作时,要让试样点刚好接触展开剂,否则不能很好地分离 |
| B、实验室制备硝基苯时,先将浓硫酸滴入浓硝酸后,冷却,再边振荡边滴加苯 |
| C、从海带中提取碘的方法是:取样→灼烧→溶解→过滤→萃取 |
| D、向盛有少量Na2O2的试管中加入少量水,并立即滴入2滴酚酞,振荡,溶液呈红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.5mol/(L?min) |
| B、0.15mol/(L?min) |
| C、0.75mol/(L?min) |
| D、0.075mol/(L?min) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=7的氨水和氯化铵混合溶液中c(NH4+)=c(Cl-) |
B、浓度均为0.1mol?L-1的 溶液和CH3COONa溶液中,溶液中c( 溶液和CH3COONa溶液中,溶液中c(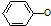 )<c(CH3COO-) )<c(CH3COO-) |
| C、pH=3的硫酸溶液和pH=11的氨水溶液等体积混合,混合后溶液显碱性 |
| D、已知酸性HF>CH3COOH,则等体积等物质的量浓度的NaF和CH3COONa溶液所含的阴离子数后者较多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl2+2NaOH═NaCl+NaClO+H2O |
| B、NH3+HCl═NH4Cl |
| C、Br2+2KI═I2+2KBr |
| D、CO2+Ca(OH)2═CaCO3+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 加热 |
| A、增大氧气浓度,平衡向正方向移动,K值不变 |
| B、降低温度,正反应速率比逆反应速率减小的程度小 |
| C、平衡时SO2气体的转化率为50% |
| D、该条件下反应放出0.5QkJ的热量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com