
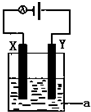
 (1)已知H-H 键能为436kJ•mol-1,H-N键键能为391kJ•mol-1,根据化学方程式:N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ•mol-1.则N≡N键的键能是945.6kJ•mol-1
(1)已知H-H 键能为436kJ•mol-1,H-N键键能为391kJ•mol-1,根据化学方程式:N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ•mol-1.则N≡N键的键能是945.6kJ•mol-1分析 (1)旧键断裂吸收的能量减去新键生成释放的能量值即为反应热,1molN2含有1molN≡N,1molH2含有1molH-H,1molNH3含有3molN-H,依据△H=反应物的总键能-生成物的总键能进行计算;
(2)常温下属于氧化还原反应的放热反应,可设计为原电池,存在元素化合价变化的反应为氧化还原反应;
(3)氢氧燃料碱性电池中,正极上氧气得电子发生还原反应;
(4)①若电解硫酸铜溶液时,阳极上氢氧根离子放电,阴极上铜离子放电,据此写出电池反应式;
②根据转移电子守恒计算阴极上析出的物质,再根据氧气计算生成的C(H+),从而得出其pH.
解答 解:(1)已知:H-H键能为436kJ/mol,N-H键键能为391kJ/mol,令N≡N键的键能为x,
对于反应N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ/mol,
反应热=反应物的总键能-生成物的总键能,故△H=xkJ/mol+3×436kJ/mol-2×3×391=-92.4kJ/mol
解得:x≈945.6kJ/mol,故答案为:945.6 kJ•mol-1;
(2)A.C(s)+H2O(g)=CO(g)+H2(g)△H>0,为氧化还原反应,但为吸热反应,不能设计为原电池,故A错误;
B.2H2(g)+O2(g)=2H2O(1)△H<0,为氧化还原反应,为放热反应,能设计为原电池,故B正确;
C.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1)△H<0,不属于氧化还原反应,不能设计为原电池,故C错误;
故选B;
(3)以KOH溶液为电解质溶液,氢氧燃料碱性电池中,正极上氧气得电子和水反应生成氢氧根离子,电极反应式为:O2+4e一+2 H2O=4OH一,故答案为:O2+4e一+2H2O=4OH一;(3)O2+4e-+2H2O=4OH-
(4)①电解硫酸铜溶液时,阳极上生成氧气,阴极上生成铜,同时溶液中生成硫酸,所以电池反应式为:2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4,故答案为:2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4;
②电解含有0.04molCuSO4和0.04molNaCl的混合溶液400ml,阳极上先生成氯气后生成氧气,阴极上先生成铜,后生成氢气,阳极上氯气完全析出时,氯气的体积=$\frac{0.04mol}{2}$×22.4L/mol=448mL<672mL,所以阳极上还有224mL氧气,阳极上转移电子的物质的量=0.04mol×1+$\frac{0.224L}{22.4L/mol}$=0.08mol,阴极上铜完全析出时,需要电子的物质的量=0.04mol×2=0.08mol,所以阴极上不析出氢气,生成224mL氧气时,阳极附近同时生成C(H+)=$\frac{\frac{0.224L}{22.4L/mol}×4}{0.4L}$=0.1mol/L,所以溶液的pH=1,
故答案为:1.
点评 本题考查构成原电池的条件、电解池的有关计算等知识点,难点是(4)中溶液pH的计算,只有明确阴阳极上析出的物质才能正确解答,为易错点


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:选择题

| A. | 红曲素含有两种含氧官能团 | |
| B. | 红曲素分子式为C21H25O5 | |
| C. | 红曲素能使酸性高锰酸钾溶液褪色 | |
| D. | lmol红曲素最多能与2 mol NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
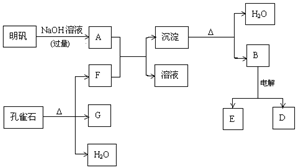
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
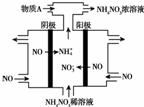 NH4NO3主要用作肥料、军用炸药、冷冻剂、制造笑气等.
NH4NO3主要用作肥料、军用炸药、冷冻剂、制造笑气等.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:2 | B. | 3:4 | C. | 2:1 | D. | 4:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 具有腐蚀性的药品必须放在玻璃器皿里称量,其他固体药品可直接放在天平托盘上称量 | |
| B. | 使用容量瓶前,在容量瓶中加适量水,用食指摁住瓶塞倒立,如不漏水,即可使用 | |
| C. | 混合浓硫酸和乙醇时,将浓硫酸慢慢加入乙醇试管中并及时搅拌 | |
| D. | 油或酒精着火时都可以用水扑灭 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 装置①可用于实验室制取乙酸乙酯 | |
| B. | 装置②可用于分离苯和硝基苯的混合物 | |
| C. | 装置③可用于以苯为原料萃取碘水中的碘 | |
| D. | 装置④可用于实验室制取乙烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com