
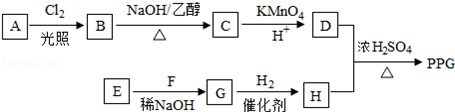
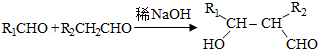
 .
. .
.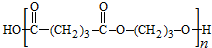 .
. (写结构简式).
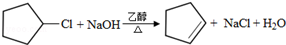
(写结构简式).分析 烃A的相对分子质量为70,由$\frac{70}{12}$=5…10,则A为C5H10,核磁共振氢谱显示只有一种化学环境的氢,故A的结构简式为 ;A与氯气在光照下发生取代反应生成单氯代烃B,则B为
;A与氯气在光照下发生取代反应生成单氯代烃B,则B为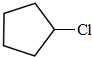 ,B发生消去反应生成C为
,B发生消去反应生成C为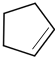 ,化合物C的分子式为C5H8,C发生氧化反应生成D为HOOC(CH2)3COOH,F是福尔马林的溶质,则F为HCHO,E、F为相对分子质量差14的同系物,可知E为CH3CHO,由信息④可知E与F发生加成反应生成G为HOCH2CH2CHO,G与氢气发生加成反应生成H为HOCH2CH2CH2OH,D与H发生缩聚反应生成PPG(
,化合物C的分子式为C5H8,C发生氧化反应生成D为HOOC(CH2)3COOH,F是福尔马林的溶质,则F为HCHO,E、F为相对分子质量差14的同系物,可知E为CH3CHO,由信息④可知E与F发生加成反应生成G为HOCH2CH2CHO,G与氢气发生加成反应生成H为HOCH2CH2CH2OH,D与H发生缩聚反应生成PPG(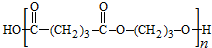 ),据此分析解答.
),据此分析解答.
解答 解:烃A的相对分子质量为70,由$\frac{70}{12}$=5…10,则A为C5H10,核磁共振氢谱显示只有一种化学环境的氢,故A的结构简式为 ;A与氯气在光照下发生取代反应生成单氯代烃B,则B为
;A与氯气在光照下发生取代反应生成单氯代烃B,则B为 ,B发生消去反应生成C为
,B发生消去反应生成C为 ,化合物C的分子式为C5H8,C发生氧化反应生成D为HOOC(CH2)3COOH,F是福尔马林的溶质,则F为HCHO,E、F为相对分子质量差14的同系物,可知E为CH3CHO,由信息④可知E与F发生加成反应生成G为HOCH2CH2CHO,G与氢气发生加成反应生成H为HOCH2CH2CH2OH,D与H发生缩聚反应生成PPG(
,化合物C的分子式为C5H8,C发生氧化反应生成D为HOOC(CH2)3COOH,F是福尔马林的溶质,则F为HCHO,E、F为相对分子质量差14的同系物,可知E为CH3CHO,由信息④可知E与F发生加成反应生成G为HOCH2CH2CHO,G与氢气发生加成反应生成H为HOCH2CH2CH2OH,D与H发生缩聚反应生成PPG(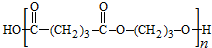 ),
),
(1)通过以上分析知,A结构简式为 ,故答案为:
,故答案为: ;
;
(2)B发生消去反应生成C,反应方程式为 ,
,
故答案为: ;
;
(3)由E和F生成G的反应类型为加成反应,G的化学名称为3-羟基丙醛,
故答案为:加成反应;3-羟基丙醛;
(4)PPG的结构简式为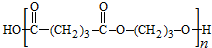 ,故答案为:
,故答案为: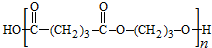 ;
;
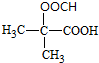
(5)既能发生银镜反应,又能发生水解反应,含有甲酸形成的酯基,可以看作丙烷中2个H原子被-COOH、-OOCH取代,当-COOH取代甲基中H原子时,-OOCH有3种位置,当-COOH取代亚甲基中H原子时,-OOCH有2种位置,共有5种,其中核磁共振氢谱为3组峰,且峰面积比为6:1:1的为: ,D及同分异构体中组成相同,由元素分析仪显示的信号(或数据)完全相同,
,D及同分异构体中组成相同,由元素分析仪显示的信号(或数据)完全相同,
故答案为:5; ;c.
;c.
点评 本题考查有机物的推断与合成,侧重考查学生分析推断能力,正确判断A的结构简式是解本题关键,注意醛醛发生加成反应结构变化特点,题目难度中等.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:实验题
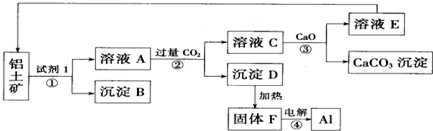
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
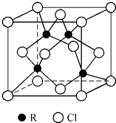 物质的组成、结构都是决定物质性质的重要因素.
物质的组成、结构都是决定物质性质的重要因素.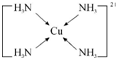 ,其中配体分子中心原子的杂化方式为sp3,与外界离子互为等电子体的一种分子的化学式为SiCl4或SiF4.
,其中配体分子中心原子的杂化方式为sp3,与外界离子互为等电子体的一种分子的化学式为SiCl4或SiF4.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2通入高锰酸钾酸性溶液中,红色褪去 | |
| B. | SO2通入品红溶液中,红色褪去 | |
| C. | SO2通入溴水溶液中,红棕色褪去 | |
| D. | SO2通入氢氧化钠与酚酞的混合溶液中,红色褪去 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
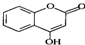 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成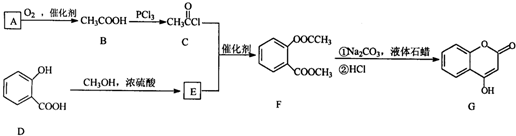
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2 | B. | 2Na2O2+2H2O═4NaOH+O2↑ | ||
| C. | 2H2O2═2H2O+O2↑ | D. | 2Al+2NaOH+2H2O═2NaAlO2+3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C(s)+O2(g)═CO(g)△H=110.5 kJ/mol | |
| B. | C(s)+O2(g)═CO2(g)△H=-393.5 kJ/mol | |
| C. | 2H2(g)+O2(g)═2 H2O(l)△H=-571.6 kJ/mol | |
| D. | H2(g)+O2(g)═H2O(g)△H=-241.8 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
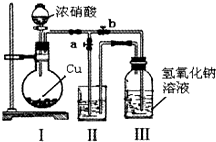 针对网络上流传的隔夜熟肉中因亚硝酸钠(NaNO2)含量严重超标而不能食用的说法,某兴趣小组开展如下探究活动:
针对网络上流传的隔夜熟肉中因亚硝酸钠(NaNO2)含量严重超标而不能食用的说法,某兴趣小组开展如下探究活动:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com