
分析 (1)镁、铝是亲氧元素,易被氧气氧化;
(2)释放出的H2 包括Mg17Al12吸收的氢,还包括镁、铝和盐酸反应生成的氢气;
(3)Al与NaOH溶液反应,而Mg与NaOH溶液不反应,溶解后过滤可实现除杂,以此来解答.
解答 解:(1)Mg、Al都是活泼的金属单质,容易被空气中的氧气氧化,通入氩气作保护气,以防止二者被氧化,
故答案为:防止Mg Al被空气氧化;
(2)1molMg17Al12完全吸氢17mol,在盐酸中会全部释放出来,镁铝合金中的镁和铝都能与盐酸反应生成H2,生成氢气的物质的量分别为17mol、12×$\frac{3}{2}$=18mol,则生成氢气一共(17+17+18)mol=52mol,
故答案为:52mol;
(3)Al与NaOH溶液反应,而Mg与NaOH溶液不反应,溶解后过滤可实现除杂,则除去镁粉中的少量铝粉,选用的试剂是NaOH溶液,发生的离子反应为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:NaOH溶液;2Al+2OH-+2H2O=2AlO2-+3H2↑.
点评 本题考查了物质分离与提纯、化学方程式计算,题目难度中等,明确发生反应实质为解答关键,注意掌握铝、镁及其化合物性质,试题培养了学生的分析、理解能力及灵活应用能力.


科目:高中化学 来源: 题型:多选题
| A. | 该溶液中一定含有SO42-、NH4+、CO32-、Cl-等离子 | |
| B. | 该溶液中至少含有0.23g Na+ | |
| C. | 该溶液中可能含有Mg2+和Cl- | |
| D. | 该溶液中含有0.355g Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaO+H2O═Ca(OH)2,可以放出大量的热,故可把该反应设计成原电池,把其中的化学能转化为电能 | |
| B. | 其他条件均相同,带有“盐桥”的原电池比不带“盐桥”的原电池电流持续时间长 | |
| C. | 原电池工作时,正极表面一定有气泡产生 | |
| D. | 钢铁水闸可用牺牲阴极或外加电流的阳极保护法防止其腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 的名称为2,3-二乙基-1-戊烯.
的名称为2,3-二乙基-1-戊烯.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
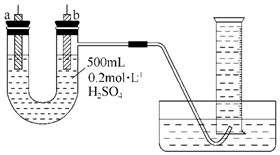 给你提供纯锌、纯铜片和500mL 0.2mol•L-1的H2SO4溶液、导线、1 000mL量筒.试用如图装置来测定锌和稀硫酸反应时在某段时间内通过导线的电子的物质的量.
给你提供纯锌、纯铜片和500mL 0.2mol•L-1的H2SO4溶液、导线、1 000mL量筒.试用如图装置来测定锌和稀硫酸反应时在某段时间内通过导线的电子的物质的量.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2(CaCO3) | B. | KCl(NaCl) | C. | Fe2O3(Al2O3) | D. | FeCl2溶液(FeCl3) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Al3+、HCO3-、NO3- | B. | AlO2-、Cl-、Mg2+、K+ | ||
| C. | NH4+、Na+、CH3COO-、NO3- | D. | Na+、NO3-、ClO-、I- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com