
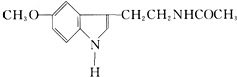
| A. | 它属于芳香族化合物 | B. | 它属于高分子化合物 | ||
| C. | 分子式为C13N2H16O2 | D. | 在一定条件下可以发生加成反应 |
分析 A.含有苯环的有机物属于芳香族化合物;
B.相对分子质量大于10000的化合物属于高分子化合物;
C.根据结构简式确定分子式;
D.该分子中含有碳碳双键和苯环,具有苯和烯烃性质.
解答 解:A.含有苯环的有机物属于芳香族化合物,该物质中含有苯环,所以属于芳香族化合物,故A正确;
B.相对分子质量大于10000的化合物属于高分子化合物,该分子相对分子质量较小,不属于高分子化合物,故B错误;
C.根据结构简式确定分子式为C13N2H16O2,故C正确;
D.该分子中含有碳碳双键和苯环,具有苯和烯烃性质,所以一定条件下能发生加成反应,故D正确;
故选B.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,侧重考查基本概念、烯烃性质,题目难度不大.


科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 活动性:Cl->Br->I- | B. | 还原性:I->Br->Cl- | ||
| C. | 稳定性:AgCl>AgBr>AgI | D. | Ksp:AgCl>AgBr>AgI |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(NO3)2溶液 | B. | AgNO3溶液 | C. | Ba(OH)2溶液 | D. | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 NaHCO3溶液与0.1 mol•L-1 NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO32-)>c(OH-) | |
| B. | 20 mL 0.1 mol•L-1 CH3COONa溶液与10 mL 0.1 mol•L-1 HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+)+c(OH-) | |
| D. | 0.1 mol•L-1 CH3COOH溶液与0.1 mol•L-1 NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的或结论 |
| A | 取酸雨试样,加入10%H2O2溶液,再加入BaCl2溶液,有白色沉淀生成 | 该酸雨试样中一定含有H2SO4 |
| B | 将锌片和银片用导线连接后同时插入盛有稀硫酸的烧杯中,银片表面产生大量气泡 | 形成的原电池中锌作负极,银作正极 |
| C | 某无色溶液,加银氨溶液,水浴加热,有银镜生成 | 溶液中一定含有醛类化合物 |
| D | 配制FeCl2溶液时,先将FeCl2溶于适量稀硝酸,再用蒸馏水稀释,最后在试剂瓶中加入少量的铁粉 | 抑制Fe2+水解,并防止Fe2+被氧化为Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com