
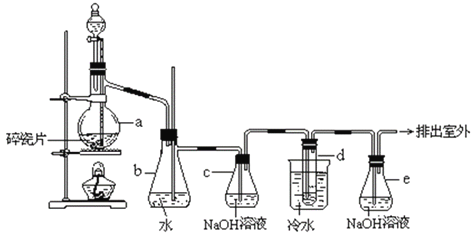
【题目】1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度 2.18 g·cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验室中可以用下图所示装置制备1,2-二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水)。填写下列空白:
(1) 写出本题中由乙醇制备1,2-二溴乙烷的两个化学反应方程式:
①____________________________________________,反应类型为________________。
②____________________________________________,反应类型为________________。
(2)装置b可以充当安全瓶,防止倒吸,例如:若装置a、b上方气体压强减小,则装置b中的现象为________________________________________________________________。
(3)容器c中NaOH溶液的作用是:________________________________;若无c装置,则d中发生副反应的离子方程式为________________________________________。
(4)在做此实验时,应使a装置中的液体温度迅速升高到所需温度,请用化学方程式表示其原因_____________________________________________________________。
【答案】CH3CH2OH ![]() CH2=CH2 +H2O 消去反应 CH2=CH2+Br2
CH2=CH2 +H2O 消去反应 CH2=CH2+Br2 ![]() CH2BrCH2Br 加成反应 空气从长导管进入 b瓶中(b中长导管有气泡冒出) 除去反应中产生的副产物 SO2 SO2 + Br2 + 2 H2O = 4H+ + SO42—+ 2Br— CH3CH2OH
CH2BrCH2Br 加成反应 空气从长导管进入 b瓶中(b中长导管有气泡冒出) 除去反应中产生的副产物 SO2 SO2 + Br2 + 2 H2O = 4H+ + SO42—+ 2Br— CH3CH2OH ![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
【解析】
(1)实验室中用乙醇和浓硫酸加热来制取乙烯,然后用乙烯和溴单质的加成反应来制得1,2-二溴乙烷;
(2)b为安全瓶,可以防止倒吸,也可以检查实验进行时试管d是否发生堵塞;
(3)氢氧化钠可以和制取乙烯中产生的杂质气体二氧化碳和二氧化硫发生反应;
(4)温度在140![]() 时,会有副反应发生;
时,会有副反应发生;
(1)实验室中用乙醇和浓硫酸加热来制取乙烯,然后用乙烯和溴单质的加成反应来制得1,2-二溴乙烷,发生反应的化学方程式为CH3CH2OH ![]() CH2=CH2 +H2O 、 消去反应 CH2=CH2+Br2
CH2=CH2 +H2O 、 消去反应 CH2=CH2+Br2 ![]() CH2BrCH2Br 、 加成反应;
CH2BrCH2Br 、 加成反应;
本题答案为:CH3CH2OH ![]() CH2=CH2 +H2O 、 消去反应,CH2=CH2+Br2
CH2=CH2 +H2O 、 消去反应,CH2=CH2+Br2 ![]() CH2BrCH2Br 、加成反应。
CH2BrCH2Br 、加成反应。
(2)b为安全瓶,可以防止倒吸, 若装置a、b上方气体压强减小,则装置b中的现象为:空气从长导管进入 b瓶中(b中长导管有气泡冒出);
本题答案为:空气从长导管进入 b瓶中(b中长导管有气泡冒出)。
(3)氢氧化钠可以和制取乙烯中产生的杂质气体二氧化碳和二氧化硫发生反应,防止造成污染,所以C中NAOH的作用是,除去乙烯中带出的酸性气体(或除去(CO2、SO2);若无C装置则在D中会发生,SO2和Br2的氧化还原反应,其离子方程式为SO2 + Br2 + 2 H2O = 4H+ + SO42—+ 2Br-;
本题答案为:除去乙烯中带出的酸性气体(或除去(CO2、SO2),SO2 + Br2 + 2 H2O = 4H+ + SO42—+ 2Br-。
(4)温度在140![]() 时,会有副反应发生;所以要求迅速升高到170
时,会有副反应发生;所以要求迅速升高到170![]() ,其副反应是CH3CH2OH
,其副反应是CH3CH2OH ![]() CH3CH2OCH2CH3+H2O;
CH3CH2OCH2CH3+H2O;
本题答案为:CH3CH2OH ![]() CH3CH2OCH2CH3+H2O。
CH3CH2OCH2CH3+H2O。


科目:高中化学 来源: 题型:
【题目】写出下列烷烃的系统名称:
①![]() ______________________________________.
______________________________________.
② _______________________________________ .
_______________________________________ .
③ ___________________________________ .
___________________________________ .
④ ____________ ;
____________ ;
(2)根据下列有机物的名称,写出相应的结构简式:
①2,4二甲基戊烷 ______ .
②2,2,5三甲基3乙基己烷 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是甲醛分子的模型,根据该图和所学化学知识回答下列问题:
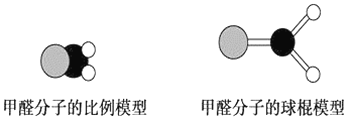
(1)甲醛分子中碳原子的杂化方式是__________,作出该判断的主要理由是__________________________。
(2)下列是对甲醛分子中碳氧键的判断,其中正确的是________(填序号)。
①单键 ②双键 ③σ键 ④π键 ⑤σ键和π键
(3)甲醛分子中C—H键与C—H键间的夹角________(填“=”、“>”或“<”)120°,出现该现象的主要原因是____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作正确的是
A. 制乙酸乙酯时,将乙醇注入浓硫酸中,冷却后加入乙酸
B. 向溴乙烷中滴加硝酸酸化的AgNO3溶液,以检验其中的溴元素
C. 用氢氧化钠溶液清洗盛过苯酚的试管
D. 在试管中加入2mL2%的CuSO4溶液,然后加入4至6滴10%的NaOH溶液振荡、再加入几滴乙醛溶液加热煮沸,可以检验乙醛分子中的醛基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废镍催化剂中主要有Ni,还有Al、Fe、SiO2及其它不溶于酸、碱的杂质。现用废镍催化剂制备NiSO4·7H2O晶体,其流程如下图:

已知:Ksp[Fe(OH)3]=8.0×10-38,Ka sp[Fe(OH)2]=8.0×10-16,K[Al(OH)3]=3.2×10-34,Ksp[Ni(OH)2]=2.0×10-15,1g2=0.3,
回答下列问题
(1)“碱浸”的目的是______。
(2)“酸浸时发生的离子方程式为Fe+2H+=Fe2++H2↑、_______。
(3)“净化除杂需要先加入H2O2溶液,发生反应的离子方程式为______,然后调节PH=_______时,使杂质离子恰好完全沉淀(注:离子浓度小于或等于1×10-5mol/L时沉淀完全)
(4)“操作A为”______。
(5)Ni2+在强碱性溶液中还可被NaClO氧化为NiOOH,该反应离子方程式为______。
(6) NiOOH也可作为原电池的电极材料,若在碱性条件下形成燃料电池,负极通入N2H4气体,则负极的电极反应式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硅晶体是空间立体网状结构,如图所示:
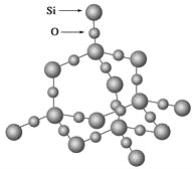
关于二氧化硅晶体的下列说法中,正确的是( )
A. 1 mol SiO2晶体中Si—O键为2 mol
B. 二氧化硅晶体的分子式是SiO2
C. 晶体中Si、O原子最外电子层都满足8电子结构
D. 晶体中最小环上的原子数为8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从古至今,铁及其化合物在人类生产生活中的作用发生了巨大改变。
(1)古代中国四大发明之一的指南针是由天然磁石制成的,其主要成分是____(填字母序号)。
a.Fe b.FeO c.Fe3O4 d.Fe2O3
(2)硫酸渣的主要化学成分为:SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%。用该废渣制取药用辅料红氧化铁的工艺流程如下(部分操作和条件略):
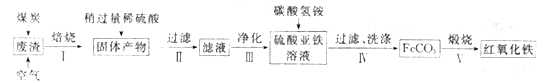
①在步骤Ⅰ中产生的有毒气体可能有_____________________。
②在步骤Ⅲ操作中,要除去的离子之一为Al3+。若常温时Ksp[Al(OH)3]=1.0×10-32,此时理论上将Al3+ 沉淀完全,则溶液的pH为_________。(c(Al3+)≤1.0×10-5mol/L 视为Al3+沉淀完全)
③步骤Ⅳ中,生成FeCO3的离子方程式是____________________________。
(3)氯化铁溶液称为化学试剂中的“多面手”。向氯化铜和氯化铁的混合溶液中加入氧化铜粉末会产生沉淀,写出该沉淀的化学式______________。请用平衡移动的原理,结合必要的离子方程式,对此现象作出解释:__________________________________________________________。
(4)①古老而神奇的蓝色染料普鲁士蓝的合成方法如下:

复分解反应Ⅱ的离子方程式是____________________________________________。
②如今基于普鲁士蓝合成原理可检测食品中是否含CN-,方案如下:

若试纸交蓝则证明食品中含有CN-,请解释检测时试纸中FeSO4的作用:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用膜技术原理和电化学原理制备少量硫酸和绿色硝化剂N2O5,装置如图所示,下列说法正确的是( )

A. 电极b反应式是O2+4e-+2H2O=4OH-
B. 电解后乙装置d电极附近溶液的pH不变
C. c电极上的电极反应式为N2O4-2e-+H2O=N2O5+2H+
D. 甲中每消耗1mol SO2,乙装置中有1mol H+通过隔膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着科技的进步,合理利用资源、保护环境成为当今社会关注的焦点。甲胺铅碘(CH3NH3PI3)引用作新敏化太阳能电池的敏化剂,可由CH3NH2、PbI2及HI为原料合成。回答下列问题:
(1)制取甲胺的反应为CH3OH(g)+NH3(g)![]() CH3NH2(g)+H2O(g) △H1。
CH3NH2(g)+H2O(g) △H1。
①NH3电子式为_______。
②已知该反应中相关化学键的键能数据如下:

则该反应的△H1=_______kJ·mol-1
(2)上述反应中所需的甲醇可以利用甲烷为原料在催化剂作用下直接氧化来合成。煤炭中加氢气可发生反应:C(s)+2H2(g)![]() CH4(g) △H2。在密闭容器中投入碳和H2,控制条件使其发生该反应,测得碳的平衡转化率随压强及温度的变化关系如图中曲线所示。
CH4(g) △H2。在密闭容器中投入碳和H2,控制条件使其发生该反应,测得碳的平衡转化率随压强及温度的变化关系如图中曲线所示。

①该反应的△H2_______0(填“>” 、“<”或“=”),判断理由是_______。
②在4MPa、1100K时,图中X点v正(H2)____ v逆(H2)(填“>”、“<”或“=”)。该条件下,将1molC和2molH2通入密闭容器中进行反应,平衡时测得的转化率为80%,CH4的体积分数为______。若维持容器体积不变,向其中再加入0.5mo1C和1mo1H2,再次达到平衡后,平衡常数K_____(填“增大”、“减小”或“不变”)。
③某化学兴趣小组提供下列四个条件进行上述反应,比较分析后,你选择的反应条件是______(填字母序号)。
A.5MPa 800K B.6MPa 1000K C.10MPa 1000K D.10MPa 1100K
(3)已知常温下PbI2饱和溶液(呈黄色)中c(Pb2+)=1.0×10-3mol·L-1,Pb(NO3)2溶液与KI溶液混合可形成PbI2沉淀。现将浓度为2×10-3mol·L-1的Pb(NO3)2溶液与一定浓度的KI溶液等体积混合,则生成沉淀所需KI溶液的最小浓度为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com