
| ||
| △ |
| 15 |
| 2 |
| ||
| △ |
| ||
| △ |
| ||
| △ |


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案科目:高中化学 来源: 题型:
| A、Na+、Fe3+、K+、NO3- |
| B、NH4+、Al3+、NO3-、Cl- |
| C、K+、AlO2-、Na+、SO42- |
| D、K+、NO3-、Na+、Ag+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蒸馏水 |
| B、0.5mol?L-1H2SO4溶液 |
| C、0.5 mol?L-1BaCl2溶液 |
| D、1.0mol?L-1H2SO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 弱电解质化学式 | CH3COOH | HCN | H2CO3 | NH3.H2O |
| 电离平衡常数 | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7K2=5.6×l0-11 | 1.8×l0-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、随着原子序数的递增,原子最外层电子总是从1到8重复出现 |
| B、元素的性质随着元素原子序数的递增而呈周期性变化 |
| C、随着元素原子序数的递增,元素最高正价从+1到+7、负价从-7到-1重复出现 |
| D、元素性质的周期性变化是指原子核外电子排布的周期性变化、原子半径的周期性变化以及元素主要化合价的周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、该卤代烃发生水解反应时,被破坏的键是①和② |
| B、该卤代烃发生消去反应时,被破坏的键是①和④ |
| C、该卤代烃发生取代反应时,被破坏的键是① |
| D、该卤代烃发生消去反应时,被破坏的键是①和② |
查看答案和解析>>
科目:高中化学 来源: 题型:
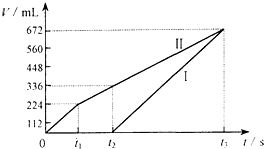 常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:
常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com