
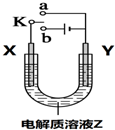
| A. | 若X、Y、Z分别为铁片、铜片、氯化铜溶液,开关K与a连接,则Y极上有气泡放出 | |
| B. | 若X、Y、Z分别为铁片、铜片、氯化铜溶液,开关K与a连接,则溶液中Cu2+向Y极移动 | |
| C. | 若X、Y、Z分别为石墨、石墨、氯化铜溶液,开关K与b连接,则溶液中Cu2+向Y极移动 | |
| D. | 若X、Y、Z分别为石墨、石墨、氯化铜溶液,开关K与b连接,则 Y极上有黄绿色气体生成 |
分析 A、若X、Y、Z分别为铁片、铜片、氯化铜溶液,开关K与a连接,构成原电池,Cu是正极;
B、若X、Y、Z分别为铁片、铜片、氯化铜溶液,开关K与a连接,构成原电池,阳离子移向正极;
C、若X、Y、Z分别为石墨、石墨、氯化铜溶液,开关K与b连接,构成电解池,则溶液中Cu2+向阴极移动;
D、X、Y、Z分别为石墨、石墨、氯化铜溶液,开关K与b连接,构成电解池,则 Y极是阴极,根据电极反应回答.
解答 解:A、若X、Y、Z分别为铁片、铜片、氯化铜溶液,开关K与a连接,构成原电池,Cu是正极,Cu极上有Cu析出,故A错误;
B、若X、Y、Z分别为铁片、铜片、氯化铜溶液,开关K与a连接,构成原电池,阳离子移向正极,Cu是正极,溶液中Cu2+向CuY电极移动,故B正确;
C、若X、Y、Z分别为石墨、石墨、氯化铜溶液,开关K与b连接,构成电解池,则溶液中Cu2+向阴极Y移动,故C正确;
D、X、Y、Z分别为石墨、石墨、氯化铜溶液,开关K与b连接,构成电解池,则 Y极是阴极,该电极上析出金属铜,故D错误.
故选BC.
点评 本题综合原电池和电解质知识,侧重于学生的分析能力和电化学知识的综合应用,注意解题时要注意分析电极反应及生成物,难度中等.


科目:高中化学 来源: 题型:解答题
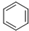 +CH3CH2CH2Cl$\stackrel{催化剂}{→}$
+CH3CH2CH2Cl$\stackrel{催化剂}{→}$  +HCl
+HCl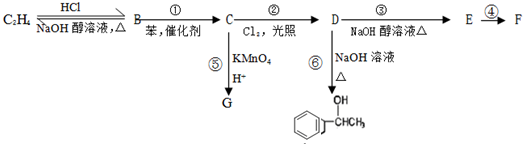
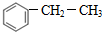 ,F的结构简式为
,F的结构简式为 ,
, .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | X | Y | Z | M |
| A | H2S | S | SO3 | O2 |
| B | Mg | C | CO | CO2 |
| C | NaOH | Na2CO3 | NaHCO3 | CO2 |
| D | NH3 | NO | NO2 | O2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑥⑦⑩ | B. | ①④⑧⑩ | C. | ③⑤⑦⑨ | D. | ③⑥⑦⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向滴加有KSCN的FeCl2溶液,不断滴加氯水 | 溶液颜色先变红后褪色 | Fe2+先是被氧化为Fe3+,后来又被还原为Fe2+ |
| B | 向浓盐酸中加入少量碳酸钠溶液,将产生的气体通入苯酚钠溶液 | 苯酚钠溶液中出现白色浑浊 | 实验有缺陷,不能证明酸性:盐酸>碳酸>苯酚 |
| C | 在酸性KMnO4溶液中通入SO2 | 溶液褪色 | SO2具有漂白性 |
| D | 用标准浓度的烧碱溶液滴定未知浓度的盐酸,酚酞做指示剂 | 锥形瓶内溶液颜色由无色变为浅红色立即停止滴定 | 酸碱恰好中和 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷和氯气光照条件下反应 | B. | CH3CH2CHBrCH3发生消去反应 | ||
| C. | 1,3-丁二烯与Br2发生加成反应 | D. | 乙烯和氯化氢发生加成反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com