
| A、镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 |
| B、已知AgCl的Ksp=1.8×10-10、Ag2CrO4的Ksp=1.2×10-12,所以相同温度下AgCl的溶解度大于Ag2CrO4 |
| C、常温下,将pH=8的醋酸钠溶液稀释,溶液中所有离子浓度都减小 |
| D、反应3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)在室温下可自发进行,则该反应的△H<0 |
| 3 | 4.0×10-12 |
| 1.8×10-10 |


科目:高中化学 来源: 题型:
| 灼烧 |
| 浸泡 |
| ① |
| ② |
| 适量Cl2 |
| ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
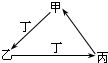 甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下图转化关系.下列有关物质的推断正确的是( )
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下图转化关系.下列有关物质的推断正确的是( )| A、若甲为焦炭,则丁可能是O2 |
| B、若甲为Fe,则丁可能是Cl2 |
| C、若甲为AlCl3,则丁可能是NH3 |
| D、若甲为NaHCO3,则丁可能是HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该溶液的pH值可能为1 |
| B、水的电离受到促进 |
| C、水的离子积将变小 |
| D、该溶液的pH值一定为13 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间t/min | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 |
| P/P0 | 1.00 | 1.50 | 1.80 | 2.20 | 2.30 | 2.38 | 2.40 | 2.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C2H2、C2H4 |
| B、C2H4、C4H6 |
| C、C2H6、C3H6 |
| D、C6H6、C2H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com