
| 实验编号 | T/K | 大理石规格 | HNO3浓度/mol·L-1 | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和__探究温度对该反应速率的影响; (Ⅲ)实验①和__探究大理石规格(粗、细)对该反应速率的影响。 |
| ② | | | | |
| ③ | | 粗颗粒 | | |
| ④ | | | |
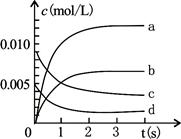
 2NO2(g),正反应放热。测得n(NO)随时间的变化如下表,请回答:
2NO2(g),正反应放热。测得n(NO)随时间的变化如下表,请回答:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
| 实验编号 | T/K | 大理石规格 | HNO3浓度/mol·L-1 | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00 | ⑴实验①和②探究HNO3浓度对该反应速率的影响; ⑵实验①和③探究温度对该反应速率的影响。 ⑶实验①和④探究大理石规格(粗、细)对该反应的影响。 |
| ② | 298 | 粗颗粒 | 1.00 | |
| ③ | 308 | 粗颗粒 | 2.00 | |
| ④ | 298 | 细颗粒 | 2.00 |
 。
。

科目:高中化学 来源:不详 题型:实验题
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 30 | 120 | 280 | 350 | 370 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 反应条件 | ||
| | H2O2的浓度(质量分数) | 温度(℃) | 催化剂的使用 |
| A | 2 | 10 | 使用MnO2 |
| B | 4 | 10 | 不使用 |
| C | 6 | 30 | 不使用 |
| D | 6 | 30 | 使用MnO2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 4ClO2↑+H++Cl-+2H2O。向亚氯酸钠溶液中加入盐酸,反应剧烈。若将盐酸改为硫酸,开始时反应缓慢,稍后一段时间产生气体速度较快,其原因可能是……( )。
4ClO2↑+H++Cl-+2H2O。向亚氯酸钠溶液中加入盐酸,反应剧烈。若将盐酸改为硫酸,开始时反应缓慢,稍后一段时间产生气体速度较快,其原因可能是……( )。| A.逸出ClO2使生成物浓度降低 | B.酸使亚氯酸的氧化性增强 |
| C.溶液中的H+起催化作用 | D.溶液中的Cl-起催化作用 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2CO(g),能使反应速率加快的措施是( )
2CO(g),能使反应速率加快的措施是( )| A.①②③⑥ | B.①②④⑥ |
| C.①②③④ | D.①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2SO3,当其他条件不变时,只改变一个反应条件,将生成SO3的反应速率的变化填入空格里(填写“增大”“减小”“不变”)
2SO3,当其他条件不变时,只改变一个反应条件,将生成SO3的反应速率的变化填入空格里(填写“增大”“减小”“不变”)| 编号 | 改变的条件 | 化学反应速率 |
| ① | 降低温度 | |
| ② | 增大O2的浓度 | |
| ③ | 使用V2O5作催化剂 | |
| ④ | 压缩体积 | |

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 Si3N4(s) + 12HCl(g) △H<0
Si3N4(s) + 12HCl(g) △H<0查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
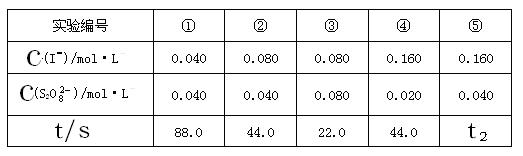
| A.<22.0s | B.22.0~44.0s | C.>44.0s | D.数据不足,无法判断 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com