
【题目】下图是氧气氧化某浓度Fe2+为Fe3+过程的实验结果,下列有关说法正确的是

A. pH=1.5时氧化率一定比pH=2.5时大
B. 其他条件相同时,80℃的氧化率比50℃大
C. Fe2+的氧化率仅与溶液的pH和温度有关
D. 该氧化过程的离子方程式为:Fe2++O2+4H+=Fe3++2H2O
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是
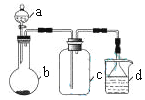
选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各反应所对应的方程式正确的是( )
A. Cl2与H2O反应:Cl2+H2O===Cl-+2H++ClO-
B. 向NaNO2溶液中滴加酸性KMnO4溶液:5NO+2MnO+3H2O===5NO+2Mn2++6OH-
C. 向NaHSO4溶液中加入Ba(OH)2溶液至SO![]() 刚好沉淀:H++SO
刚好沉淀:H++SO![]() +Ba2++OH-===BaSO4↓+H2O
+Ba2++OH-===BaSO4↓+H2O
D. 向Ba(OH)2溶液中加入硫酸:Ba2++SO![]() ===BaSO4↓
===BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求回答下列问题:
(1)下列纯净物中:a.NaOH b.Ar c.MgCl2 d.HCl e.NH3 f.KNO3
①不含化学键的物质是_______(填序号,下同)。
②既含有离子键又含有共价键的物质是______。
③只含有离子键的物质是________。
(2)下列变化中,不需要破坏化学键的是______。
A.氯化氢溶于水 B.加热氯酸钾使其分解
C.碘升华 D.氯化钠溶于水
(3)实验室盛放碱液的试剂瓶不能用玻璃塞,以氢氧化钠为例,用离子方程式表示其原因:_________,任写一个制造普通玻璃的主要反应的化学方程___________________。
(4)硅是良好的半导体材料,写出工业上生产粗硅的化学方程式:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】初中化学教材中“家庭小实验”是利用家庭日常生活用品进行化学学习和探究的活动。食盐、食醋、纯碱等均为家庭厨房中常用的物质,利用这些物质你能完成的实验是
①检验自来水中是否含氯离子 ②鉴别食盐和纯碱 ③检验鸡蛋壳能否溶于酸 ④除去热水瓶中的水垢
A.①②③④B.②③④C.②④D.①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 液态HCl不导电,所以HCl是非电解质
B. BaSO4溶于水的部分能够电离,所以BaSO4是电解质
C. 液态Cl2不导电,所以Cl2是非电解质
D. NH3的水溶液能够导电,所以NH3是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
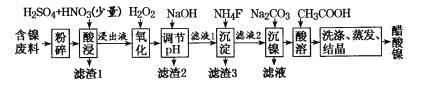
【题目】醋酸镍((CH3COO)2Ni]是一种重要的化工原料。一种以含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)为原料,制取醋酸镍的工艺流程图如下:
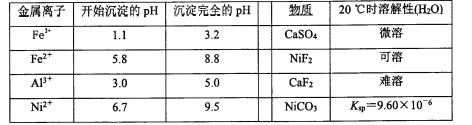
相关离子生成氢氧化物的pH和相关物质的溶解性如下表:
(1)粉碎含镍废料的作用__________________________________
(2)酸浸过程中,l molNiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应的化学方程式:___。
(3)写出氧化步骤中加入H2O2发生反应的离子方程式:____。
(4)调节pH除铁、铝步骤中,溶液pH的调节范围是____。
(5)滤渣3主要成分的化学式是____。
(6)沉镍过程中,若c(Ni2+)= 2.0 mol.L-1,欲使100 mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤10-5 mol·L-1],则需要加入Na2CO3固体的质量最少为____g(保留一位小数)。
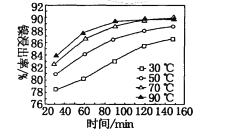
(7)保持其他条件不变,在不同温度下对含镍废料进行酸浸,镍浸出率随时间变化如图。酸浸的最佳温度与时间分别为____℃、______min。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的离子方程式正确的是
A. 明矾做净水剂:Al3++ 3H2O = Al (OH)3↓+ 3H+
B. 小苏打治疗胃酸过多:CO32-+ 2H+= CO2↑+ H2O
C. 漂白液加白醋,提高漂白效率:CH3COOH + ClO-=HClO + CH3COO-
D. 酸化的淀粉碘化钾溶液在空气中放置一段时间变蓝:4I-+ O2+2H2O= 2I2+ 4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下向100mLFeCl3溶液中通入0.224L H2S,生成单质硫,再加入过量铁粉,反应停止后溶液中含有0.06mol阳离子。原FeCl3溶液的物质的量浓度是
A. 0.2 mol/L B. 0.3 mol/L C. 0.4 mol/L D. 0.6 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com