
| A. | 1 mol的CH4质量为16g/mol | |
| B. | 3.01×1023个CO2分子的质量约为22g | |
| C. | H2O的摩尔质量为18g | |
| D. | 标准状况下,1 mol任何物质体积均为22.4L |
分析 A.质量的单位为g,g/mol为摩尔质量的单位;
B.根据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$计算二氧化碳的质量;’
C.摩尔质量的单位为g/mol;
D.没有指出物质状态,不能使用标况下的气体摩尔体积计算.
解答 解:A.1 mol的CH4质量为:16g/mol×1mol=16g,故A错误;
B.3.01×1023个CO2分子的物质的量为0.5mol,其质量约为:44g/mol×0.5mol=22g,故B正确;
C.H2O的摩尔质量为18g/mol,故C错误;
D.标况下1mol气体的体积约为22.4L,若不是气体,其体积不一定为22.4L,故D错误;
故选B.
点评 本题考查了物质的量的计算,题目难度不大,明确质量与摩尔质量的区别为解答关键,注意掌握物质的量与其它物理量之间的关系,试题培养了学生的分析能力及化学计算能力.


 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案科目:高中化学 来源: 题型:选择题
| A. | 立即关闭煤气阀门 | B. | 立即打开排风扇 | ||
| C. | 立即在家打电话通知煤气管理所 | D. | 用明火查找漏气部位 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.1mol/LNa2CO3溶液:c(Na+)=2c(H2CO3)+2 c(HCO3-)+c(CO32?) | |
| B. | 能使酚酞溶液呈红色的溶液:Na+、Ba2+、I-、NO3-可以大量共存 | |
| C. | 任何条件下,pH=1的硫酸溶液中:c(H+)=0.1mol/L | |
| D. | 将0.2 mol•L-1的HCN溶液和0.1 mol•L-1的NaOH溶液等体积混合,溶液显碱性,则c(HCN)=c(CN-)=c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
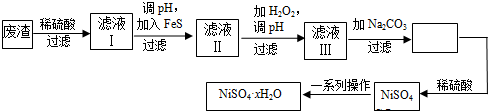
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgCl2 的摩尔质量为95 g | |
| B. | 常温常压下,1 mol CO2的质量是44 g | |
| C. | 标准状况下,1 mol H2O所占的体积约为22.4 L | |
| D. | 100 mL 1mol/L的稀硫酸中含有H+ 的数目约为6.02×1022 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某化学小组设计如图装置,探究铜和一定量的浓HNO3是否反应是否有NO生成.已知:A试管内空气体积为50mL(标准状况),B广口瓶盛80mL水,硝酸不溶于煤油.
某化学小组设计如图装置,探究铜和一定量的浓HNO3是否反应是否有NO生成.已知:A试管内空气体积为50mL(标准状况),B广口瓶盛80mL水,硝酸不溶于煤油.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
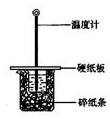 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:| 实 验 用 品 | 溶 液 温 度 | 中和热△H | |||
| t1 | t2 | ||||
| ① | 50mL0.55mol•L-1NaOH | 50mL.0.5mol•L-1HCl | 20℃ | 23.3℃ | |
| ② | 50mL0.55mol•L-1NaOH | 50mL.0.5mol•L-1HCl | 20℃ | 23.5℃ | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 转移溶液后未洗涤烧杯和玻璃棒就直接定容 | |
| B. | 称量时左码右物 | |
| C. | 定容后把容量瓶倒转摇匀,发现液面低于刻度,再滴加几滴水至刻度线 | |
| D. | 在容量瓶中进行定容时俯视刻度线 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com