
| 1 |
| 2 |
| A、-488.3kJ.mol-1 |
| B、-244.15kJ.mol-1 |
| C、+488.3kJ.mol-1 |
| D、+244.15-488.3kJ.mol-1 |
| 1 |
| 2 |


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、凡是放热反应都是自发的,吸热反应都是非自发的 |
| B、自发反应一定是熵增大,非自发反应一定是熵减小 |
| C、熵增且放热的反应一定是自发反应 |
| D、非自发反应在任何条件下都不能实现 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、50mL2mol/LCaCl2溶液 |
| B、100mL2moL/LNaCl溶液 |
| C、50mL4mol/LCaCl2溶液 |
| D、100mL4mol/LNaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、22.4 L氢气中,一定含有氢原子2NA |
| B、在常温常压下,28gCO和N2的混合气体中含有的分子数为NA |
| C、常温下,pH=1的盐酸溶液,含有H+数目是0.1NA |
| D、标准状态下,2.7g铝和足量的浓硝酸反应,转移的电子数是0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

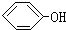 合成
合成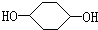 (部分试剂和反应条件已略去)
(部分试剂和反应条件已略去)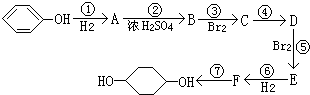
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com