
| A. | vA=0.005 mol•(L•min)-1 | B. | vC=0.025mol•(L•min)-1 | ||
| C. | vB=0.150mol•(L•min)-1 | D. | vD=0.015mol•(L•min)-1 |
分析 将A与B的混合气体1mol放入容积为2L的密闭容器内,经过4min达到平衡,此时容器内的压强是反应前的3/5,此时容器中的物质的量是6mol,根据三行式集结合反应速率等于浓度变化量和时间的比值来计算.
解答 解:将A与B的混合气体1mol放入容积为2L的密闭容器内,经过4min达到平衡,此时容器内的压强是反应前的3/5,此时容器中的物质的量是6mol,设:A的初始物质的量是x,则B的初始物质的量是1-x,A的物质的量变化量是y,
2A(g)+3B(g)?C(g)+2D(g),
初始物质的量:x 1-x 0 0
变化物质的量:y 1.5y 0.5y y
平衡物质的量:x-y 1-x-1.5y 0.5y y
x-y+1-x-1.5y+0.5y+y=0.6,解得y=0.4,所以vA=$\frac{\frac{0.4mol}{2L}}{4min}$=0.05 mol•(L•min)-1,各物质表示的反应速率之比等于系数之比,所以vC=$\frac{1}{2}$vA=0.025mol•(L•min)-1,vB=0.075mol•(L•min)-1,vD=0.050mol•(L•min)-1,
故选B.
点评 本题考查学生化学反应速率的有关计算知识,注意各物质表示的反应速率之比等于系数之比这一结论的应用是关键,难度中等.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  2-乙基-1,3-丁二烯 2-乙基-1,3-丁二烯 | B. | CH2=CH-CH2-CH3,1-丁烯 | ||
| C. |  1,3-二丙醇 1,3-二丙醇 | D. | CH2 CH3,1,4-二甲苯 CH3,1,4-二甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 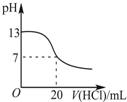 表示25℃时,用0.1mol•L-1盐酸滴定20mL 0.1mol•L-1氨水 | |
| B. | 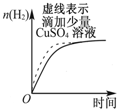 表示常温下,等量锌粉分别与两份足量的等体积等浓度的盐酸反应 | |
| C. | 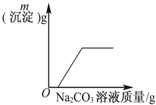 表示向CaCl2和盐酸的混合溶液中滴加Na2CO3溶液 | |
| D. |  表示向盐酸溶液中滴入氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 标准状况下,1.8g水中所含有氧原子数目为0.1NA | |
| B. | 常温常压下,2.24LCO2气体中含氧原子数目为0.2NA | |
| C. | 0.1mol/LCuCl2溶液中,含有Cl-离子的数目为0.2NA | |
| D. | 常温常压下,23gNa+中含有的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 +O2$\stackrel{催化剂}{→}$
+O2$\stackrel{催化剂}{→}$ △H=-116kJ.mol-1
△H=-116kJ.mol-1 $\stackrel{H+}{→}$
$\stackrel{H+}{→}$ △H=-253kJ.mol-1
△H=-253kJ.mol-1| 物质 | 相对分子质量 | 密度(g/cm-3) | 沸点/℃ |
| 苯酚 | 94 | 1.0722 | 182 |
| 丙酮 | 58 | 0.7898 | 56.5 |
| 异丙苯 | 120 | 0.8640 | 153 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.5mol | B. | 0.7mol | C. | 0.8mol | D. | 0.9mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
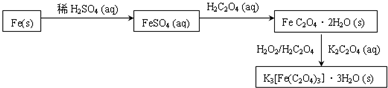
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com