
【题目】2019年诺贝尔化学奖授予锂离子电池的发明者,锂离子电池是目前应用广泛的一类电池。以钛铁矿(主要成分为FeTiO3,含有少量MgO、Fe2O3、SiO2等杂质)为原料,制备锂离子电池电极材料的工艺流程如图所示:
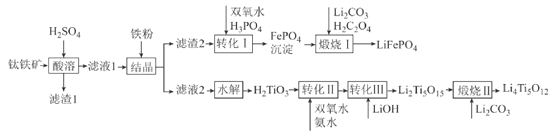
已知:①滤液1中含Ti微粒的主要存在形式为TiO2+;
②)Ksp(FePO4)=1.3×10-22、Ksp[Mg3(PO4)2]=1.0×10-24;溶液中某离子浓度小于等于10-5mol·L-1时,认为该离子沉淀完全。
请回答下列问题:
(1)滤渣1中主要成分的化学式为__。
(2)“结晶”温度需控制在70℃左右,若温度过高会导致的后果为__。
(3)“转化I”后所得溶液中c(Mg2+)=0.01mol·L-1,若其中Fe3+沉淀完全,则溶液中c(PO43-)的范围为__。
(4)“煅烧I”反应中氧化剂和还原剂的物质的量之比为__。
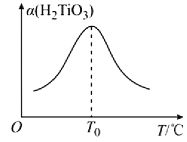
(5)“转化II”中H2TiO3的转化率(α)与温度(T)的关系如图所示。T0℃时,一定时间内H2TiO3的转化率最高的原因为__。
(6)Li2Ti5O15中-1价与-2价O原子的数目之比为___。“煅烧II”反应中同时生成两种参与大气循环的气体,该反应的化学方程式为__。
(7)某锂离子电池放电时的电池反应为Li1-xFePO4+LixC6=LiFePO4+6C,则充电时阳极的电极反应式为__。
【答案】SiO2 TiO2+会提前水解而降低H2TiO3的产率,且使滤渣2中混有杂质 ![]() mol/L
mol/L ![]() c(PO43-)<1.0
c(PO43-)<1.0![]() 10-9mol/L 2:1 温度低于T0℃时,反应速率随温度升高而加快,H2TiO3的转化率升高,高于T0℃时后,双氧水分解和氨气的挥发导致反应速率减小,使H2TiO3的转化率降低 8:7 Li2Ti5O15+Li2CO3
10-9mol/L 2:1 温度低于T0℃时,反应速率随温度升高而加快,H2TiO3的转化率升高,高于T0℃时后,双氧水分解和氨气的挥发导致反应速率减小,使H2TiO3的转化率降低 8:7 Li2Ti5O15+Li2CO3![]() Li4Ti5O12+2O2
Li4Ti5O12+2O2![]() +CO2
+CO2![]() LiFePO4-xe-= Li1-xFePO4+xLi+
LiFePO4-xe-= Li1-xFePO4+xLi+
【解析】
铁矿石加入硫酸溶解过滤得到滤渣为二氧化硅,滤液1为MgCl2、FeCl3、TiOSO4,加铁粉与过量硫酸反应并调pH,滤液中TiO2+水解得到H2TiO3,加入过氧化氢和氨水、氢氧化锂溶液得到沉淀Li2Ti5O15,加入碳酸锂煅烧得到钛酸锂Li4Ti5O12,滤渣2加入过氧化氢氧化亚铁离子,加入磷酸得到沉淀磷酸铁,加入碳酸锂和草酸煅烧得到磷酸亚铁锂LiFePO4;据此分析解答。
(1)钛铁矿的成分中只有SiO2不溶于硫酸,滤渣1的成分为SiO2,故答案为:SiO2;
(2)“结晶”温度需控制在70℃左右,如果温度过高,TiO2+会提前水解而降低H2TiO3的产率,且使滤渣2中混有杂质,故答案为:TiO2+会提前水解而降低H2TiO3的产率,且使滤渣2中混有杂质;
(3)Fe3+刚好沉淀完全时,c(PO43-)=![]() =
=![]() mol/L,要保证Fe3+沉淀完全,c(PO43-)应该
mol/L,要保证Fe3+沉淀完全,c(PO43-)应该![]()
![]() mol/L;c(Mg2+)=0.01mol·L-1,若刚好产生沉淀,c(PO43-)=
mol/L;c(Mg2+)=0.01mol·L-1,若刚好产生沉淀,c(PO43-)=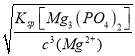 =
=![]() =1.0
=1.0![]() 10-9mol/L,而按题意分析应不能使镁离子沉淀,故c(PO43-)<1.0
10-9mol/L,而按题意分析应不能使镁离子沉淀,故c(PO43-)<1.0![]() 10-9mol/L,故答案为:
10-9mol/L,故答案为:![]() mol/L
mol/L ![]() c(PO4span>3-)<1.0
c(PO4span>3-)<1.0![]() 10-9mol/L;
10-9mol/L;
(4)“煅烧I”反应中氧化剂为FePO4,反应后被还原为LiFePO4,1mol氧化剂得到1mol电子;还原剂为H2C2O4,被氧化成CO2,1mol还原剂失去2mol电子,根据电子守恒,氧化剂与还原剂的物质的量比值为:2:1,故答案为:2:1;
(5)“转化II”中H2TiO3的转化率(α)与温度(T)的关系如图所示,温度低于T0℃时,反应速率随温度升高而加快,H2TiO3的转化率升高,高于T0℃时后,双氧水分解和氨气的挥发导致反应速率减小,使H2TiO3的转化率降低,所以T0℃时,一定时间内H2TiO3的转化率最高,故答案为:温度低于T0℃时,反应速率随温度升高而加快,H2TiO3的转化率升高,高于T0℃时后,双氧水分解和氨气的挥发导致反应速率减小,使H2TiO3的转化率降低;
(6)Li2Ti5O15中Li显+1价,Ti显+4价,根据代数和为零可算出15个O共显-22价,设-1价O数目为x,-2价O数目为y,有x+y=15;-x-2y=-22,算出x=8,y=7,-1价与-2价O原子的数目之比为8:7;“煅烧II”反应中同时生成的两种参与大气循环的气体应为O2和CO2,可写出化学方程式为:Li2Ti5O15+Li2CO3![]() Li4Ti5O12+2O2
Li4Ti5O12+2O2![]() +CO2
+CO2![]() ;故答案为:8:7;Li2Ti5O15+Li2CO3
;故答案为:8:7;Li2Ti5O15+Li2CO3![]() Li4Ti5O12+2O2
Li4Ti5O12+2O2![]() +CO2
+CO2![]() ;
;
(7)电池反应为Li1-xFePO4+LixC6=LiFePO4+6C,LixC6为负极,Li1-xFePO4为正极,充电时阳极反应应该是LiFePO4变为Li1-xFePO4,电极反应式为:LiFePO4-xe-= Li1-xFePO4+xLi+,故答案为:LiFePO4-xe-= Li1-xFePO4+xLi+。


科目:高中化学 来源: 题型:
【题目】现有常温下甲、乙、丙三种溶液,甲为0.1 mol·L-1的NaOH溶液,乙为0.1 mol·L-1的HCl溶液,丙为0.1 mol·L-1的CH3COOH溶液,试回答下列问题:
(1)甲溶液的pH=________。
(2)丙溶液中存在的电离平衡为______________(用电离平衡方程式表示)。
(3)常温下,用水稀释0.1 mol·L-1的CH3COOH溶液时,下列各量随水量的增加而增大的是________(填序号)。
①n(H+) ②c(H+) ③ c(CH3COOH)/c(CH3COO-) ④c(OH-)
(4)甲、乙、丙三种溶液中由水电离出的c(OH-)的大小关系为___________。
(5)某同学用甲溶液分别滴定20.00 mL乙溶液和20.00 mL丙溶液,得到如图所示的两条滴定曲线,请回答有关问题:
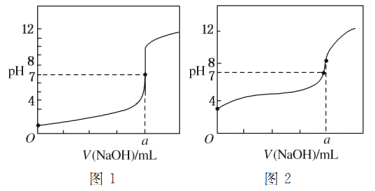
①甲溶液滴定丙溶液的曲线是________(填“图1”或“图2”)曲线。
②a=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱工业中电解饱和食盐水的原理示意图如图所示(电极均为石墨电极)。下列说法中正确的是( )

A. M为电子流出的一极
B. 通电使氯化钠发生电离
C. 电解一段时间后,阴极区pH降低
D. 电解时用盐酸调节阳极区的pH在2~3,有利于气体逸出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在潮湿的深层土壤中,钢管主要发生厌氧腐蚀,有关厌氧腐蚀的机理有多种,其中一种理论为厌氧细菌可促使SO42-与H2反应生成S2-,加速钢管的腐蚀,其反应原理如图所示。下列说法正确的是
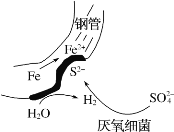
A.正极的电极反应式为O2+4e-+2H2O=4OH-
B.钢管腐蚀的直接产物中含有FeS、Fe(OH)2
C.SO42-与H2的反应可表示为4H2+SO42--8e- S2-+4H2O
S2-+4H2O
D.在钢管表面镀锌或铜可减缓钢管的腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以废旧锂离子电池的正极材料(主要含LiCoO2、Al、C等)为原料制备CoC2O4.2H2O的一种实验流程如图:
![]()
![]()
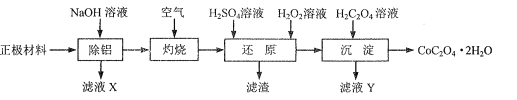
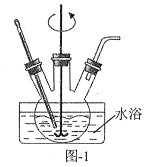
(1)“除铝”可在如图1所示的装置中进行。保持温度、反应物和溶剂的量不变,实验中提高铝的去除率的措施有___。
(2)“灼烧”的主要目的是___。
(3)“还原”步骤温度在70℃左右,LiCoO2发生反应的化学方程式为___。若该步骤用盐酸代替H2SO4和H2O2,也可达到“还原”的目的,但其缺点是___。
(4)“沉淀”步骤中,证明Co2+已沉淀完全的实验操作及现象是___。
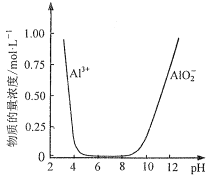
(5)设计由“滤液X”制备纯净的Al2O3的实验方案。(已知含铝物种浓度与pH的关系如图所示。实验中必须使用的试剂:H2SO4溶液、BaCl2溶液、蒸馏水)___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,X的原子半径是所有短周期主族元素中最大的,W的核外电子数与X、Z的最外层电子数之和相等,Y的原子序数是Z的最外层电子数的2倍,由W、X、Y三种元素形成的化合物M的结构如图所示。下列叙述正确的是( )
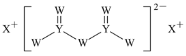
A.元素非金属性强弱的顺序为W>Y>Z
B.Y单质的熔点高于X单质
C.W分别与X、Y、Z形成的二元化合物均只有一种
D.化合物M中W不都满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)FeCl3的水溶液呈___________(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):____________________________________________,
(2)实验室在配制好的FeCl3溶液中加少许稀盐酸的目的是:__________________ 。
(3)把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是__________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知向某溶液中逐滴加入NaOH溶液时,测得生成沉淀的质量随所加入NaOH的体积变化如图所示,则该溶液中大量含有的离子可能是()
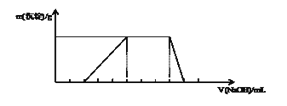
A. H+、NH4+、Mg2+、NO3-
B. H+、Al3+、AlO2-、NH4+
C. H+、NH4+、Al3+、Cl-
D. NH4+、Al3+、Cl-、SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com