
【题目】下列实验方案中,可以达到实验目的的是
选项 | 实验操作与现象 | 目的或结论 |
A | 用pH试纸分别测定相同温度和相同浓度的CH3COONa溶液和NaClO溶液的pH | 验证酸性:CH3COOH>HClO |
B | 在一定条件下,向混有少量乙烯的乙烷中通入氢气 | 除去乙烷中的乙烯 |
C | 向盛有少量Mg(OH)2固体的试管中加入适量NH4Cl浓溶液,充分振荡,白色固体溶解 |
|
D | 向NaI、NaCl混合稀溶液中滴加少量稀AgNO3溶液,有黄色沉淀生成 | Ksp(AgI)<Ksp(AgCl) |
A.AB.BC.CD.D
科目:高中化学 来源: 题型:
【题目】发展新能源、改善空气质量等一直是化学研究的热点。回答下列问题:
(1)甲醇是可再生的清洁能源,可利用CO2与H2合成甲醇:CO2(g)+3H2(g)CH3OH(g)+H2O(g)。该反应历程如图所示。

上述合成甲醇的反应的有机副产物有__________;由于该反应速率较慢,需要加入催化剂使反应速率加快,主要降低下列变化中________(填字母)的能量变化。
A.*CO+*OH→*CO+*H2O B.*CO→*OCH
C.*OCH2→*OCH3 D.*OCH3→*CH3OH
(2)焦炭与水蒸气在恒容密闭容器中反应,可制合成气,主要反应(I)、(II)的lg KP(KP为以分压表示的平衡常数)与T的关系如图所示。

①反应(I)的△H______0(填“>”、“=”或“<”);
②在容积为10 L密闭容器中充入1 mol CO、1 mol H2O只发生反应(II),反应5分钟到达图中d点,请计算0~5 min时,CO平均反应速率________;此时CO的转化率为________;已知:反应速率v=v正-v逆=k正·x(CO)·x(H2O)-k逆·x(CO2)·x(H2),k正、k逆分别为正、逆反应速率常数,x为物质的量分数,计算e处的![]() =______;
=______;
③c点时,若反应容器中CO浓度为0.1 mol/L,则CO2浓度为________(填数值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物电化学系统有两个研究方向。一是利用阳极室微生物降解有机废水,二是利用阴极还原能力处理含重金属废水。某文献报道,利用下图所示装置可使微生物和六价铬离子(Cr2O72—)不直接接触,处理高浓度含铬废水。装置工作时,下列说法错误的是( )
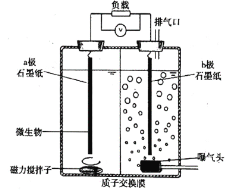
A.![]() 极附近
极附近![]() 增大
增大
B.该装置利用微生物产生电子和![]()
C.![]() 极石墨纸发生反应:
极石墨纸发生反应:![]()
D.利用该装置原理既能处理含铬废水,又能同步回收电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法正确的是
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的能量多
B.由C(石墨)→C(金刚石);△H=+1.9kJmol-1可知,金刚石比石墨稳定
C.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,则H2燃烧热的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ·mol-1
D.在稀溶液中,H+(aq)+OH-(aq)=H2O(l) △H=-57.3 kJ·mol-1,若将含0.5mol H2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量大于57.3KJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极极板,通过导线与直流电源相连。下列说法不正确的是 ( )
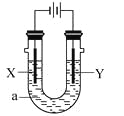
A. 若电镀铜,则Y为铜电极,电解液a可以是硫酸铜或氯化铜溶液
B. 若X为铁电极、Y为石墨电极,电解饱和氯化钠溶液一段时间,在两极分别滴加酚酞,X极变红色
C. 若用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,加入0.1mol的氢氧化铜溶解,刚好恢复到通电前的浓度,则电解过程中转移的电子为0.2mol
D. 若X、Y为铂电极,a溶液为250mL CuSO4和KNO3的混合液,经过一段时间后,两极均得到标准状况下5.6L气体,则原混合液中CuSO4的物质的量浓度为1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将6.72L标况下的氯气通入到500ml一定物质的量浓度的氢氧化钠溶液中,恰好完全反应。则
①该氢氧化钠溶液的浓度是多少?②生成次氯酸钠的质量是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸氯喹用于治疗对氯喹敏感的恶性疟、间日疟及三日疟。若干位药物研发和临床专家研究发现,该药物在细胞水平上能有效抑制新型冠状病毒的感染。
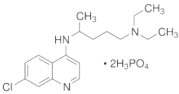
(1)磷酸氯喹是由多种元素形成的物质,其中氯元素的基态氯原子,电子占据的最高能层符号为_____;磷元素的简单氢化物PH3的中心原子杂化方式是_____,属于_______(填“极性”或“非极性”)分子;其他的四种元素的第一电离能从大到小的顺序为_________。
(2)N与P为同族元素,比较其最高价氧化物的水化物酸性并从结构的角度说明理由:________
(3)H3PO4与Fe3+形成H3[Fe(PO4)2],此性质常用于掩蔽溶液中的Fe3+。基态Fe3+的核外电子排布式为___________;![]() 做为配体为铁离子提供______。
做为配体为铁离子提供______。
(4)磷化铜(Cu3P2)用于制造磷青铜。磷青铜是含少量锡、磷的铜合金,主要用作耐磨零件和弹性原件,其晶胞结构如图所示:
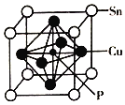
①其化学式为__________
②铜或铜盐的焰色反应为_____色,金属元素能产生焰色实验的微观原因为______。
③若晶体密度为ρg/cm3,摩尔质量为Mg/mol,NA代表阿伏加德罗常数,则最近的Cu原子核间距为________________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由反应物X转化为Y和Z的能量变化如图所示。下列说法错误的是( )
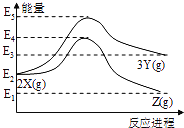
A. 由![]() 反应的ΔH >0
反应的ΔH >0
B. 由![]() 反应的ΔH = (E2-E1) kJ/mol
反应的ΔH = (E2-E1) kJ/mol
C. 降低压强有利于提高Y的产率
D. 降低温度有利于提高Z的产率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知单质铜与稀硝酸的反应为3Cu+8HNO3===2NO↑+4H2O+3Cu(NO3)2(Cu的相对原子质量为64)。现把19.2 g Cu放入200 mL 5 mol·L-1硝酸中,充分反应,问:
(1)哪种物质过量?______
(2)参加反应的硝酸的物质的量为多少?______
(3)在标准状况下产生的气体的体积为多少?______
(4)生成水的分子数为多少?______
(5)若反应前后溶液的体积不变,则生成Cu(NO3)2的物质的量浓度为多少?______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com