
| A. | 0.4mol | B. | 0.3 mol | C. | 0.2mol | D. | 0.1 mol |
分析 根据电解池的工作原理,要想让电解后的电解质复原,则遵循的原则是:出什么加什么,电解发生2H2O+2CuSO4$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4 ,向所得溶液中加入0.1mol氢氧化铜充分反应后,溶液恰好恢复到电解前的状态,则电解生成了0.1 mol Cu,并电解了0.1 mol H2O,以此来解答;
解答 解:Cu(OH)2从组成上可看成CuO•H2O,加入0.1 mol Cu(OH)2后恰好恢复到电解前的浓度和pH,即电解生成了0.1 mol Cu,并电解了0.1 mol H2O,由电解的总反应式:
2H2O+?2CuSO4$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4 转移电子
2mol 4mol
0.1mol 0.2mol
2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑转移电子
2mol 4mol
0.1mol 0.2mol
所以电解过程中共转移电子为0.4 mol.
故选:A.
点评 本题考查电解原理,为高频考点,把握“加入0.1molCu(OH)2充分反应后,溶液恰好恢复到电解前的状态”发生的电解反应为解答的关键,侧重电极反应、原子守恒及转移电子计算的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | V(逆)>V(正) | B. | V(逆)<V(正) | ||
| C. | V(逆)>V(正),正逆反应停止 | D. | V(逆)=V(正),正逆反应仍进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲、乙、丙三种单质全是非金属 | |
| B. | 上述转化关系所涉及的化合物中有一种是电解质 | |
| C. | 上图所示的五个转化关系中,有三个是化合反应 | |
| D. | 上图所示的五个转化关系中,均为放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
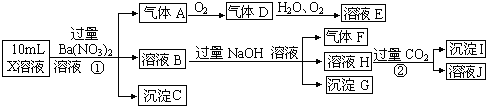
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
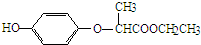
| A. | 含1mol HPE的溶液最多可以和2molNaOH反应 | |
| B. | HPE不能跟浓溴水反应 | |
| C. | 1molHPE能与4molH2发生加成反应 | |
| D. | HPE分子中最多有12个原子共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
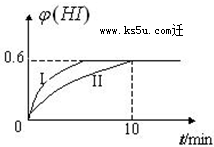 将1mol I2(g) 和2mol H2(g)置于2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)?2HI(g);△H<0,2min时,测得I2的物质的量为0.6mol.10min后达到平衡,HI的体积分数φ(H)随时间变化如下图中曲线II所示.
将1mol I2(g) 和2mol H2(g)置于2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)?2HI(g);△H<0,2min时,测得I2的物质的量为0.6mol.10min后达到平衡,HI的体积分数φ(H)随时间变化如下图中曲线II所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
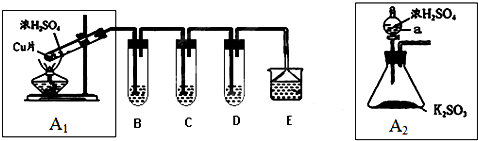
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:9 | B. | 1:49 | C. | 1:99 | D. | 以上都不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池是化学能转化成电能的装置 | |
| B. | 化学键断裂时吸收能量,形成时放出能量 | |
| C. | 化学反应中吸热反应时△H>0,放热反应时△H<0 | |
| D. | 标准状况下,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量为该物质的燃烧 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com