



科目:高中化学 来源: 题型:
| A、Z可表示为MY2 |
| B、Z可表示为M2Y |
C、Z的电子式可表示为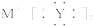 |
| D、M形成+2价阳离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某高一化学课外活动小组进行下列实验.
某高一化学课外活动小组进行下列实验.查看答案和解析>>
科目:高中化学 来源: 题型:
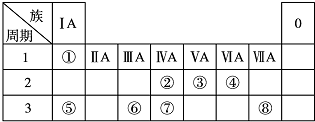


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)A、B两元素均位于周期表中第三周期,它们的原子核外最外层电子数之和为7,其中A元素的原子核外最外层电子数为1个,两者间可形成化合物A2B.根据以上条件回答下列问题:
(1)A、B两元素均位于周期表中第三周期,它们的原子核外最外层电子数之和为7,其中A元素的原子核外最外层电子数为1个,两者间可形成化合物A2B.根据以上条件回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、通甲醇一极为正极 |
| B、当转移24mol电子时,消耗的甲醇2mol |
| C、电池工作时电流从甲醇一极流向氧气一极 |
| D、正极电极反应式 3O2+12H++12e-═6H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com