
【题目】Ⅰ.已知HClO是比H2CO3还弱的酸,HClO的电离平衡常数为2.95×10-5,H2CO3的电离平衡常数为K1=4.3×10-7和K2=5.6×10-11氯水中存在下列平衡:Cl2+H2O![]() HCl+HClO,HClO
HCl+HClO,HClO![]() H++ClO-,达平衡后
H++ClO-,达平衡后
(1)要使HClO浓度增加,可加入下列物质________(填代号)。
A.SO2 B.NaHCO3 C.HCl D.NaOH
(2)由此说明在实验室可用排饱和食盐水收集Cl2的理由是________________。
Ⅱ.Al(OH)3的电离方程式可表示为:H2O+AlO2-+H+![]() Al(OH)3
Al(OH)3![]() Al3++3OH-。
Al3++3OH-。
试根据平衡移动原理,解释下列有关问题。
(1)向Al(OH)3沉淀中加入盐酸,沉淀溶解,其原因是_________________,有关离子方程式为__________________。
(2)向Al(OH)3沉淀中加入苛性钠溶液,沉淀溶解,其原因是________________,有关离子方程式为__________________。
【答案】Ⅰ.(1)B (2)饱和食盐水中Cl-浓度较大,由于氯水中存在平衡:Cl2+H2O![]() Cl-+HClO+H+,所以,氯气在饱和食盐水中溶解度较小,通常情况下,可用排饱和食盐水的方法收集氯气
Cl-+HClO+H+,所以,氯气在饱和食盐水中溶解度较小,通常情况下,可用排饱和食盐水的方法收集氯气
Ⅱ.(1)盐酸中的H+与OH-结合生成水,使平衡中c(OH-)减小,平衡向右移动,Al(OH)3沉淀不断溶解Al(OH)3+3H+===Al3++3H2O
(2)苛性钠溶液中OH-结合H+生成水,使上述平衡中c(H+)减小,平衡向左移动,Al(OH)3沉淀不断溶解 Al(OH)3+OH-===AlO2-+2H2O
【解析】(1)要使HClO浓度增加,需使平衡向正反应方向移动,SO2和HCl都不能是平衡正向移动NaOH能使平衡正向移动,但是消耗HCl的同时也消耗HClO,使得HClO的浓度减小,NaHCO3只与HCl反应,与HClO不反应,使平衡正向移动,同时使HClO的浓度增加,B项正确。


科目:高中化学 来源: 题型:
【题目】已知某气体反应的平衡常数可表示为K=c(CH3OCH3)c(H2O)/[c(CH3OH)]2 , 该反应在不同温度下的平衡常数:400℃,K=32;500℃,K=44.
请回答下列问题:
(1)写出上述反应的化学方程式
(2)该反应的正反应是反应(填“放热”或者“吸热”),
(3)已知在密闭容器中,测得某时刻各组分的浓度如下:
物质 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
浓度/(molL﹣1) | 0.54 | 0.68 | 0.68 |
①此时系统温度400℃,比较正、逆反应速率的大小:v正v逆 (填“>”、“<”或“=”).
②若以甲醇百分含量为纵坐标,以温度为横坐标,此时反应点在图象的位置是图中点.比较图中B、D两点所对应的正反应速率BD(填“>”、“<”或“=”).理由是 . 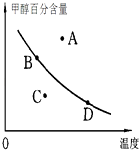
(4)一定条件下要提高反应物的转化率,可以采用的措施是
a.升高温度 b.加入催化剂 c.压缩容器的体积
d.增加水蒸气的浓度 e.及时分离出产物.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2和NOx都是大气污染物.
(1)汽车排放的尾气中含CO和NO,汽车发动机工作时产生的NO和CO可通过催化转化器转化为两种无污染的气体,该反应的化学方程式是
(2)采取还原法,用炭粉可将氮氧化物还原.
已知:N2(g)+O2(g)═2NO(g)△H=+180.6kJmol﹣1;C(s)+O2(g)═CO2(g)△H=﹣393.5kJmol﹣1
则反应C(s)+2NO(g)═CO2(g)+N2(g)△H=kJmol﹣1 .
(3)将NO2变成无害的N2要找到适合的物质G与适当的反应条件,G应为(填写“氧化剂”或“还原剂”).下式中X必须为无污染的物质,系数n可以为0;NO2+G ![]() N2+H2O+nX (未配平的反应式);
N2+H2O+nX (未配平的反应式);
下列化合物中,满足上述反应式中的G是(填写字母);
a.NH3b.CO2c.SO2d.CH3CH2OH
(4)利用氨水可以将SO2和NO2吸收,原理如图1所示:NO2被吸收的离子方程式是 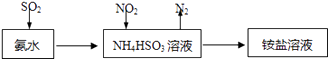
(5)利用图2所示装置(电极均为惰性电极)也可吸收SO2 , 并用阴极排出的溶液吸收NO2 . 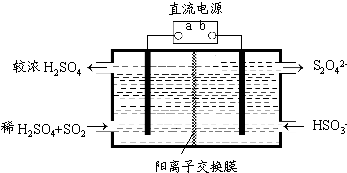
①b极的电极反应式为;
②在碱性条件下,用阴极排出的溶液吸收NO2 , 使其转化为无害气体,同时有SO32﹣生成.该反应离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂废水中含1.00×10﹣2mol/L的Cr2O72﹣ , 其毒性较大.某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4 , 设计了如图实验,下列说明正确的是( ) 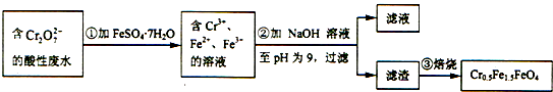
A.根据第①步反应可知还原性:Cr3+大于Fe2+
B.第②步过滤得到的滤渣中主要成分为Cr(OH)3、Fe(OH)2 , 不含Fe(OH)3
C.欲使1L该废水中的Cr2O72﹣完全转化为Cr0.5Fe1.5FeO4 , 理论上需要加入27.8g FeSO47H2O
D.第③步高温焙烧过程用到的主要实验仪器中属于硅酸盐质的有:酒精灯、蒸发皿、泥三角
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加等质量的铝,生成氢气的体积比为5:6,则甲、乙两烧杯中的反应情况可能分别是( )
A.甲、乙中都是铝过量
B.甲中铝过量,乙中碱过量
C.甲中酸过量,乙中铝过量
D.甲中酸过量,乙中碱过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(多选)下列说法正确的是( )
A.油脂是高级脂肪酸的甘油酯
B.油脂有油和脂肪之分,但都属于酯
C.油脂水解可得到氨基酸和甘油
D.油脂不能使溴水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按以下步骤可从![]() 合成
合成![]() (部分试剂和反应条件已略去)
(部分试剂和反应条件已略去)

(1)写出有关物质的结构简式:
A_______________;
C_______________。
(2)指出反应类型:
C→D:___________________________;
F→G:___________________________;
(3)写出下列反应的化学方程式:
D+E→F:_________________________;
F→G:____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com