
反应N2O4(g)  2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是( )
2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是( )

A.a、c两点的反应速率:a>c
B.a、c两点气体的颜色:a深、c浅
C.a、b两点气体的平均相对分子质量:a>b
D.b、c两点化学平衡常数:b<c
科目:高中化学 来源:2014高考化学二轮专题突破 专题十一常见金属元素练习卷(解析版) 题型:选择题
下列物质的转化在给定条件下能实现的是( )

A.①②④ B.②③④ C.①②③ D.③④
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题五离子反应练习卷(解析版) 题型:选择题
下列离子方程式书写正确的是( )
A.在100 mL浓度为1 mol·L-1的 Fe(NO3)3的溶液中通入足量SO22Fe3++SO2+2H2O=2Fe2++SO42-+4H+
B.在100 mL浓度为2 mol·L-1的FeI2的溶液中通入标准状况下5.6 L的Cl24Fe2++6I-+5Cl2=4Fe3++3I2+10Cl-
C.向NaHCO3溶液中加入过量的澄清石灰水2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+CO32-
D.向明矾溶液中加入过量的氢氧化钡溶液Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题二化学用语及常用计量练习卷(解析版) 题型:选择题
下列微粒中,对水的电离平衡不产生影响的是( )
A.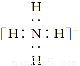 B.
B. C.26R3+ D.
C.26R3+ D.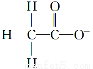
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题九化学反应速率化学平衡练习卷(解析版) 题型:选择题
已知反应①:CO(g)+CuO(s)??CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)  Cu(s)+H2O(g)在相同温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g)
Cu(s)+H2O(g)在相同温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g)  CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
A.反应①的平衡常数K1=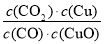
B.反应③的平衡常数K=K1/K2
C.对于反应③,恒容时,若温度升高,H2的浓度减小,则该反应的焓变为正值
D.对于反应③,恒温恒容时,若增大压强,H2的浓度一定减小
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题三溶液组成的计量及其应用练习卷(解析版) 题型:选择题
36.5 g HCl溶解在1 L水中(水的密度近似为1 g·mL-1),所得溶液的密度为ρ g·mL-1,质量分数为W,物质的量浓度为c mol·L-1,NA表示阿伏加德罗常数,则下列叙述中正确的是( )
A.所得溶液的物质的量浓度:c=1 mol·L-1
B.所得溶液中含有NA个HCl分子
C.36.5 g HCl气体占有的体积为22.4 L
D.所得溶液的质量分数:W=36.5 c/(1 000ρ)
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题三溶液组成的计量及其应用练习卷(解析版) 题型:选择题
只给出下列甲和乙中对应的量,不能求出物质的量的是( )
ABCD
甲物质的粒子数标准状况下的气体摩尔体积固体的体积溶液中溶质的物质的量浓度
乙阿伏加德罗常数标准状况下的气体体积固体的密度溶液的体积
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题一物质的组成性质和分类练习卷(解析版) 题型:填空题
(1)下列说法不正确的是________(填字母序号)。
A.60周年国庆阅兵车HQE顶级红旗采用全铝车身,铝的氧化物属于碱性氧化物
B.用热的纯碱溶液洗涤沾有油污的器具时发生的主要是化学变化
C.英国华裔科学家高锟因在“光在纤维中的传输应用于光学通信方面”做出了突破性成就,而获得了2009年诺贝尔物理学奖,光纤制品的基本原料为SiO2
D.液氨、液氯、液态氯化氢都是非电解质
E.丁达尔效应可用于区别溶液与胶体,云、雾均能产生丁达尔效应
F.化学变化前后原子的种类、数目不变,分子数目也不变
(2)人们对酸碱的认识,已有几百年的历史,经历了一个由浅入深,由低级到高级的认识过程。
①1887年阿仑尼乌斯提出电离理论。
②1923年丹麦化学家布朗斯特和英国化学家劳莱提出了质子论。凡是能够释放质子(氢离子)的任何含氢原子的分子或离子都是酸;凡是能与质子(氢离子)结合的分子或离子都是碱。按质子理论:下列粒子的水溶液既可看作酸又可看作碱的是________(填字母序号)。
AH2O;BNH4+;COH-;DHCO3-;ECH3COO-;FCl-
③1923年路易斯(Lewis)提出了广义的酸碱概念。凡是能给出电子对而用来形成化学键的物质是碱;凡是能和电子对结合的物质都是酸。如
酸(电子对接受体) 碱(电子对给予体) 反应产物
H+ + [OH]- → HOH
试指出下列两个反应中的酸或碱:
H3BO3+H2O=H++[B(OH)4]-
该反应中的碱是________(填“H3BO3”或“H2O”);
CuCl2+4NH3=[Cu(NH3)4]2++2Cl-
该反应中的酸是________(填“CuCl2”或“NH3”)。
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题7电解质溶液练习卷(解析版) 题型:选择题
常温常压下,将a mol CO2气体通入1 L b mol/L的NaOH溶液中,下列对所得溶液的描述不正确的是( )
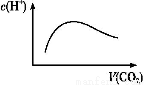
A.当a=2b时,随着CO2气体的通入,溶液中由水电离出的c(H+)有如图变化关系
B.当a=b时,所得溶液中存在:c(OH-)+c(C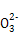 )=c(H+)+c(H2CO3)
)=c(H+)+c(H2CO3)
C.当2a=b时,所得溶液中存在:c(Na+)>c(C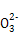 )>c(OH-)>c(HC
)>c(OH-)>c(HC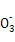 )>c(H+)
)>c(H+)
D.当1/2<a/b<1时,所得溶液中一定存在:c(Na+)=c(C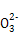 )+c(HC
)+c(HC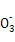 )+c(H2CO3)
)+c(H2CO3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com