
| a | | | |||||||||||||||
| | | | | | e | f | g | | |||||||||
| | b | | | | hh | | | | |||||||||
| c | | | | | | | d | [ | d | | | | | | | | |
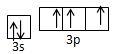
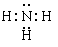 ,三角锥 , sp3
,三角锥 , sp3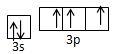 。
。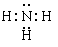 。
。

科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
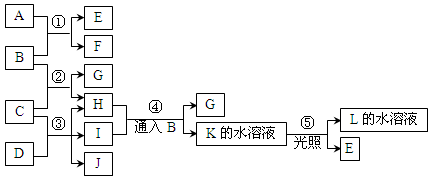
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.它位于元素周期表第六周期ⅡA族 | B.它的碳酸盐易溶于H2O |
| C.它的单质与H2O发生剧烈反应,放出H2 | D.它的氢氧化物是弱碱 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.处于最低能量的原子叫做基态原子 |
| B.在同一能级上运动的电子,其运动状态有可能完全相同 |
| C.电子的运动与行 星相似,围绕原子核在固定的轨道上高速旋转 |
| D.同一原子中,1s、2s、3s电子的能量逐渐增加,2p、3p、4p能级的轨道数依次增多 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
科目:高中化学 来源:不详 题型:推断题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.非金属性比氯强 |
| B.最高正价为+5,负价为-3 |
| C.最高价氧化物的水化物是一种强酸 |
| D.处于元素周期表中第二周期第ⅥA族 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com