
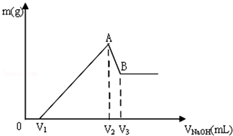
 将Mg、Al组成的混合物共0.1mol溶于100mL 3mol/LHCl溶液中,再滴加1mol/LNaOH 溶液,在滴加NaOH溶液的过程中,沉淀的质量m随NaOH溶液体积V的变化如图所示:
将Mg、Al组成的混合物共0.1mol溶于100mL 3mol/LHCl溶液中,再滴加1mol/LNaOH 溶液,在滴加NaOH溶液的过程中,沉淀的质量m随NaOH溶液体积V的变化如图所示:分析 镁铝的混合物溶于盐酸溶液中,发生反应生成氯化镁和氯化铝,先反应后的溶液中滴入氢氧化钠溶液,在氢氧化钠体积小于V1时,氢氧化钠与没有反应的盐酸反应,故0~V1mL时,不产生沉淀,氢氧化钠体积为V1mL~V2mL,氯化镁和氯化铝与开始氢氧化钠反应生成氢氧化镁和氢氧化铝,在A点时沉淀达到最大量;氢氧化钠体积为V2mL~V3mL氢氧化铝和氢氧化钠反应,生成偏铝酸钠,当氢氧化钠体积为V2mL,镁离子和铝离子恰好沉淀,溶液中阳离子为Na+,阴离子为Cl-,即溶液中的溶质为NaCl,n(Na+)=n(Cl-),其中Na+来自NaOH,Cl-来自HCl,故当氢氧化钠体积为V2mL,n(NaOH)=n(HCl),据此进行计算.
解答 解:镁铝的混合物溶于盐酸溶液中,发生反应生成氯化镁和氯化铝,先反应后的溶液中滴入氢氧化钠溶液,在氢氧化钠体积小于V1时,氢氧化钠与没有反应的盐酸反应,故0~V1mL时,不产生沉淀,氢氧化钠体积为V1mL~V2mL,氯化镁和氯化铝与开始氢氧化钠反应生成氢氧化镁和氢氧化铝,在A点时沉淀达到最大量;氢氧化钠体积为V2mL~V3mL氢氧化铝和氢氧化钠反应,生成偏铝酸钠,当氢氧化钠体积为V2mL,镁离子和铝离子恰好沉淀,溶液中阳离子为Na+,阴离子为Cl-,即溶液中的溶质为NaCl,n(Na+)=n(Cl-),其中Na+来自NaOH,Cl-来自HCl,
(1)根据分析可知,A点的沉淀为:Mg(OH)2、Al(OH)3,
故答案为:Mg(OH)2、Al(OH)3;
(2)0-V1的离子方程式为:OH-+H+=H2O;AB段反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:OH-+H+=H2O; Al(OH)3+OH-=AlO2-+2H2O;
(3)镁和流程的物质的量为0.1mol,根据质量守恒定律,则A点生成沉淀的物质的量为0.1mol;
加入V2mLNaOH时,n(NaOH)=n(HCl)=3mol•L-1×0.1L=0.3mol,
V[NaOH(aq)]=$\frac{0.3mol}{1mol/L}$=0.3L=300mL,
故答案为:0.1mol;300mL;
(4)若V1=60mL,说明盐酸有剩余,剩余盐酸的物质的量=1mol/L×0.06L=0.06mol,则和金属反应的盐酸的物质的量=3mol/L×0.1L-0.06mol=0.24mol,设镁的物质的量是x,铝的物质的量是y,
则:$\left\{\begin{array}{l}{x+y=0.1}\\{2x+3y=0.24}\end{array}\right.$,解得:$\left\{\begin{array}{l}{x=0.06}\\{y=0.04}\end{array}\right.$,
所以镁的物质的量是0.06 mol,铝的物质的量是0.04 mol,
答:若V1=60mL,列式计算混合物中Mg、Al的物质的量各为0.06mol、0.04mol.
点评 本题以图象题的形式考查镁铝单质及其化合物性质、混合物反应的计算,题目难度较大,分析图象各阶段的发生的反应是解题关键,注意掌握常见金属及其化合物性质,明确混合物计算的常用方法.


科目:高中化学 来源: 题型:选择题
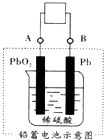 电瓶车所用的电池一般是铅蓄电池,图是一种典型的可充电电池,电池总反应式为:
电瓶车所用的电池一般是铅蓄电池,图是一种典型的可充电电池,电池总反应式为:| A. | 放电时电极 PbO2 发生氧化反应 | |
| B. | 放电时电子流向由B到A | |
| C. | 工作时蓄电池里电解质溶液的pH不变 | |
| D. | 充电时阴极反应是PbSO4-2e-+2H2O═PbO2+4H++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁粉跟稀硫酸反应 2Fe+6H+=2Fe3++3H2↑ | |
| B. | 铝跟氢氧化钠溶液反应 2Al+2H2O+2OH-=2 AlO2-+3H2↑ | |
| C. | 氯气和水的反应 C12+H2O=2H++C1-+ClO- | |
| D. | 少量铜屑放入稀硝酸中 Cu+4H++2NO3-=Cu2++2NO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
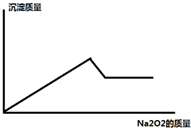 某溶液中,可能含有Al3+、Fe3+、K+、Mg2+、Fe2+、Cu2+中的一种或几种,现加入过氧化钠只产生无色无味的气体 并同时析出白色沉淀,加入过氧化钠的量与产生沉淀的量之间的关系如图
某溶液中,可能含有Al3+、Fe3+、K+、Mg2+、Fe2+、Cu2+中的一种或几种,现加入过氧化钠只产生无色无味的气体 并同时析出白色沉淀,加入过氧化钠的量与产生沉淀的量之间的关系如图查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室用苯和浓硝酸、浓硫酸发生反应制取硝基苯的装置图如图所示.回答下列问题:
实验室用苯和浓硝酸、浓硫酸发生反应制取硝基苯的装置图如图所示.回答下列问题: .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com