
”¾ĢāÄæ”æ0.2 molijĢžAŌŚŃõĘųÖŠĶźČ«Č¼ÉÕŗó£¬Éś³ÉCO2ŗĶH2Oø÷1.2 mol”£ŹŌ»Ų“š£ŗ
(1) ĢžAµÄ·Ö×ÓŹ½ĪŖ________________”£
(2) ČōČ”Ņ»¶ØĮæµÄøĆĢžAĶźČ«Č¼ÉÕŗó£¬Éś³ÉCO2ŗĶH2Oø÷3 mol£¬ŌņÓŠ________gĢžA²Ī¼ÓĮĖ·“Ó¦£¬Č¼ÉÕŹ±Ļūŗıź×¼×“æöĻĀµÄŃõĘų___________L”£
(3) ČōĢžA²»ÄÜŹ¹äåĖ®ĶŹÉ«£¬µ«ŌŚŅ»¶ØĢõ¼žĻĀÄÜÓėĀČĘų·¢ÉśČ”“ś·“Ó¦£¬ĘäŅ»ĀČČ”“śĪļÖ»ÓŠŅ»ÖÖ£¬ŌņĢžAµÄ½į¹¹¼ņŹ½ĪŖ_________________________”£
(4) ČōĢžAÄÜŹ¹äåĖ®ĶŹÉ«£¬ŌŚ“߻ƼĮ×÷ÓĆĻĀ£¬ÓėH2¼Ó³É£¬Ęä¼Ó³É²śĪļ¾²ā¶Ø·Ö×ÓÖŠŗ¬ÓŠ4øö¼×»ł£¬ĢžAæÉÄÜÓŠµÄ½į¹¹¼ņŹ½ĪŖ
______________________________________________________”££ØČĪŠ“Ņ»ÖÖ£©
(5) ±ČĢžAÉŁŅ»øöĢ¼Ō×ÓĒŅÄÜŹ¹äåĖ®ĶŹÉ«µÄAµÄĶ¬ĻµĪļÓŠ________ÖÖĶ¬·ÖŅģ¹¹Ģ唣
”¾“š°ø”æ C6H12 42 100.8 ![]() £ØCH3£©2CHC£ØCH3£©=CH2»ņ£ØCH3£©2C=C£ØCH3£©2»ņ£ØCH3£©3CCH=CH2£» 5
£ØCH3£©2CHC£ØCH3£©=CH2»ņ£ØCH3£©2C=C£ØCH3£©2»ņ£ØCH3£©3CCH=CH2£» 5
”¾½āĪö”æ£Ø1£©Ä³ĢžA 0.2mol ŌŚŃõĘųÖŠĶźČ«Č¼ÉÕŗó£¬Éś³ÉCO2ŗĶH2Oø÷1.2mol£¬Ōņ·Ö×ÓÖŠŗ¬ÓŠN£ØC£©=6£¬n£ØH£©=12£¬·Ö×ÓŹ½ĪŖC6H12£»
£Ø2£©ČōČ”Ņ»¶ØĮæµÄøĆĢžAĶźČ«Č¼ÉÕŗó£¬Éś³ÉCO2ŗĶH2Oø÷3mol£¬ÓÉ·Ö×Ó×é³ÉæÉÖŖĢžĪŖ0.5mol£¬ÖŹĮæĪŖ0.5mol”Į£Ø84g/mol£©=42g£¬ĻūŗÄŃõĘųµÄĪļÖŹµÄĮæĪŖ0.5mol”Į£Ø6+![]() £©=4.5mol£¬Ģå»żĪŖ4.5mol”Į22.4L/mol=100.8L£»
£©=4.5mol£¬Ģå»żĪŖ4.5mol”Į22.4L/mol=100.8L£»
£Ø3£©C6H12Ö»ÓŠ1øö²»±„ŗĶ¶Č£¬ČōĢžA²»ÄÜŹ¹äåĖ®ĶŹÉ«£¬ŌņĘäĪŖ»·ĶéĢž£®ĘäÖŠ£¬ÄÜÓėĀČĘų·¢ÉśČ”“ś·“Ó¦£¬ĘäŅ»ĀČ“śĪļÖ»ÓŠŅ»ÖֵďĒ»·¼ŗĶ飬¼“![]() £»
£»
£Ø4£©ĢžAÄÜŹ¹äåĖ®ĶŹÉ«£¬ŌŚ“߻ƼĮ×÷ÓĆĻĀ£¬ÓėH2¼Ó³É£¬Ęä¼Ó³É²śĪļ¾²ā¶Ø·Ö×ÓÖŠŗ¬ÓŠ4øö¼×»ł£¬ĖµĆ÷ĢžÖŠŗ¬ÓŠC=C£¬ĘäÖŠ£¬ŗ¬ÓŠ4øö¼×»łµÄÓŠ3ÖÖ£¬ĘäĢ¼¼Ü½į¹¹ĪŖ£Ø¢Ł¢Ś¢Ū“¦æÉ·Ö±š²»Ķ¬Ź±°²ÅÅĖ«¼ü£©£ŗ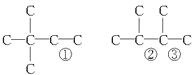 £¬ĢžAæÉÄÜÓŠµÄ½į¹¹¼ņŹ½ĪŖ£ØCH3£©3C-CH=CCH2”¢CH3-C£ØCH3£©=C£ØCH3£©-CH3”¢CH3CH£ØCH3£©-C£ØCH3£©=CH2µČ”£
£¬ĢžAæÉÄÜÓŠµÄ½į¹¹¼ņŹ½ĪŖ£ØCH3£©3C-CH=CCH2”¢CH3-C£ØCH3£©=C£ØCH3£©-CH3”¢CH3CH£ØCH3£©-C£ØCH3£©=CH2µČ”£
£Ø5£©±ČĢžAÉŁŅ»øöĢ¼Ō×ÓĒŅÄÜ·¢Éś·“Ó¦¶ųŹ¹äåĖ®ĶŹÉ«£¬ĖµĆ÷ŗ¬ÓŠĢ¼Ģ¼Ė«¼ü£¬ĖłŅŌAĪŖĪģĻ©£¬Ģ¼¼ÜŅģ¹¹ÓŠČżÖÖ£ŗÖ÷Į“5øöĢ¼Ō×Ó£ŗC-C-C-C-C£ŗ¼ÓČėĖ«¼ü·½Ź½ÓŠ2ÖÖ£¬·Ö±šĪŖ£ŗCH2=CH-CH2-CH2-CH3”¢CH3-CH=CH-CH2-CH3£¬Ö÷Į“ĖÄøöĢ¼Ō×Ó![]() £¬¼ÓČėĖ«¼ü·½Ź½ÓŠ3ÖÖ£¬·Ö±šĪŖCH2=C£ØCH3£©-CH2-CH3”¢CH3-C£ØCH3£©=CH-CH3”¢CH3-CH£ØCH3£©-CH=CH2£¬Ö÷Į“ČżøöĢ¼Ō×Ó
£¬¼ÓČėĖ«¼ü·½Ź½ÓŠ3ÖÖ£¬·Ö±šĪŖCH2=C£ØCH3£©-CH2-CH3”¢CH3-C£ØCH3£©=CH-CH3”¢CH3-CH£ØCH3£©-CH=CH2£¬Ö÷Į“ČżøöĢ¼Ō×Ó![]() £¬ÓÉÓŚÖŠ¼äµÄĢ¼Ō×Ó“ļµ½±„ŗĶ£¬²»æÉÄÜ“ęŌŚĢ¼Ģ¼Ė«¼ü£¬ĖłŅŌ×ܹ²“ęŌŚ5ÖÖĪģĻ©µÄĶ¬·ÖŅģ¹¹Ģ唣
£¬ÓÉÓŚÖŠ¼äµÄĢ¼Ō×Ó“ļµ½±„ŗĶ£¬²»æÉÄÜ“ęŌŚĢ¼Ģ¼Ė«¼ü£¬ĖłŅŌ×ܹ²“ęŌŚ5ÖÖĪģĻ©µÄĶ¬·ÖŅģ¹¹Ģ唣



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ»ÆŗĻĪļ·Šµć±Č½Ļ“ķĪóµÄŹĒ£ŗ(””””)
A. ±ūĶ飾ŅŅĶ飾¼×Ķé B. ÕżĪģĶ飾ŅģĪģĶ飾ŠĀĪģĶé
C. ĮŚ¶ž¼×±½£¾¼ä¶ž¼×±½£¾¶Ō¶ž¼×±½ D. ¶Ō¶ž¼×±½£¾ĮŚ¶ž¼×±½£¾¼ä¶ž¼×±½
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÓĆ·ÖŅŗĀ©¶·æÉŅŌ·ÖĄėµÄŅ»×é»ģŗĻĪļŹĒ( )
A.äåŗĶCCl4 B.±½ŗĶäå±½
C.Ļõ»ł±½ŗĶĖ® D.ĘūÓĶŗĶ±½
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĆčŹöČõµē½āÖŹµēĄėĒéæöæÉŅŌÓƵēĄė¶ČŗĶµēĄėĘ½ŗā³£Źż±ķŹ¾£¬ĻĀ±ķŹĒ³£ĪĀĻĀ¼øÖÖČõµē½āÖŹµÄµēĄėĘ½ŗā³£Źż£ŗ
Ėį»ņ¼ī | µēĄė³£Źż(Ka»ņKb) | ÄŃ£ØĪ¢£©ČÜĪļ | ČܶȻż³£Źż£ØKsp£© |
CH3COOH | 1£®8”Į10£5 | BaSO4 | 1”Į10-10 |
HNO2 | 4£®6”Į10£4 | BaCO3 | 2.6”Į10-9 |
HCN | 5”Į10£10 | CaSO4 | 7”Į10-5 |
HClO | 3”Į10£8 | CaCO3 | 5”Į10-9 |
NH3”¤H2O | 1£®8”Į10£5 |
Ēė»Ų“šĻĀĆęĪŹĢā£ŗ
£Ø1£©ÉĻŹöĖÄÖÖĖįÖŠ£¬ĖįŠŌ×īČõµÄŹĒ_____________ (ÓĆ»ÆѧŹ½±ķŹ¾)”£ĻĀĮŠÄÜŹ¹“×ĖįČÜŅŗÖŠCH3COOHµÄµēĄė³Ģ¶ČŌö“󣬶ųµēĄė³£Źż²»±äµÄ²Ł×÷ŹĒ________________(ĢīŠņŗÅ)”£
A£®ÉżøßĪĀ¶Č B£®¼ÓĖ®Ļ”ŹĶ
C£®¼ÓÉŁĮæµÄCH3COONa¹ĢĢå D£®¼ÓÉŁĮæ±ł“×Ėį
£Ø2£©CH3COONH4µÄĖ®ČÜŅŗ³Ź________ (Ń”Ģī”°ĖįŠŌ”±”°ÖŠŠŌ”±»ņ”°¼īŠŌ”±)£¬ĄķÓÉŹĒ__________________£¬ČÜŅŗÖŠø÷Ąė×ÓÅØ¶Č“óŠ”µÄ¹ŲĻµŹĒ_____________________”£
£Ø3£©ĪļÖŹµÄĮæ1”Ć1µÄNaCNŗĶHCNµÄ»ģŗĻČÜŅŗ£¬ĘäpH£¾7£¬øĆČÜŅŗÖŠĄė×ÓµÄÅØ¶Č“Ó“óµ½Š”ÅÅĮŠĪŖ_____________________________________”£
£Ø4£©¹¤ŅµÖŠ³£½«BaSO4×Ŗ»ÆĪŖBaCO3ŗó£¬ŌŁ½«ĘäÖĘ³Éø÷ÖÖæÉČÜŠŌµÄ±µŃĪ£ØČē£ŗBaCl2£©”£¾ßĢå×ö·ØŹĒÓƱ„ŗĶµÄ“æ¼īČÜŅŗ½žÅŻBaSO4·ŪÄ©£¬²¢²»¶Ļ²¹³ä“æ¼ī£¬×īŗóBaSO4×Ŗ»ÆĪŖBaCO3”£ĻÖÓŠ×ćĮæµÄBaSO4Šü×ĒŅŗ£¬ŌŚøĆŠü×ĒŅŗÖŠ¼Ó“æ¼ī·ŪÄ©²¢²»¶Ļ½Į°č£¬ĪŖŹ¹SO42-ĪļÖŹµÄĮæÅØ¶Č“ļµ½0.0lmol”¤L-1ŅŌÉĻ£¬ŌņČÜŅŗÖŠCO32-ĪļÖŹµÄĮæÅضČÓ¦ ”Ż____________mol”¤L-1”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĆ¾”¢ĀĮ”¢ĶČżÖÖ½šŹō·ŪÄ©»ģŗĻĪļ£¬¼ÓČė¹żĮæŃĪĖį³ä·Ö·“Ó¦£¬¹żĀĖŗóĻņĀĖŅŗÖŠ¼ÓČė¹żĮæÉÕ¼īČÜŅŗ£¬ŌŁ¹żĀĖ£¬ĀĖŅŗÖŠ“ęŌŚµÄĄė×ÓÓŠ£Ø””””£©
A.AlO2©
B.Cu2+
C.Al3+
D.Mg2+
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĒéæö»į¶ŌČĖĢå½”æµŌģ³É½Ļ“óĪ£ŗ¦µÄŹĒ£Ø””””£©
A.×ŌĄ“Ė®ÖŠĶØČėÉŁĮæCl2½ųŠŠĻū¶¾É±¾ś
B.ĪŖĘÆ°×Ņų¶ś“óĮæŹ¹ÓĆSO2
C.ÓĆŹ³“×ĒåĻ“ČČĖ®ĘæµØÄŚ±Śø½×ŵÄĖ®¹ø
D.ÓĆŠ”ĖÕ“ņ·¢½ĶĆęĶÅÖĘ×÷ĀųĶ·
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĖµ·ØÖŠ²»ÕżČ·µÄŹĒ ( )
A.ŅŅ“¼Óė½šŹōÄĘ·“Ó¦Ź±,ŹĒŅŅ“¼·Ö×ÓÖŠµÄO”ŖH¼ü¶ĻĮŃ
B.¼ģŃéŅŅ“¼ÖŠŹĒ·ńŗ¬ÓŠĖ®æɼÓČėÉŁĮæĪŽĖ®ĮņĖįĶ,Čō±äĄ¶É«Ōņŗ¬Ė®
C.½ūÖ¹ÓĆ¹¤Ņµ¾Ę¾«ÅäÖĘŅūÓĆ¾ĘŗĶµ÷Ī¶ÓƵÄĮĻ¾Ę
D.¼×Ķ锢ŅŅĻ©”¢±½”¢ŅŅ“¼¶¼ŹĒĪŽÉ«²»ČÜÓŚĖ®µÄÓŠ»ś»ÆŗĻĪļ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĪļÖŹŹōÓŚÓĶÖ¬µÄŹĒ( )
¢Ł¶¹ÓĶ ¢ŚĘūÓĶ ¢ŪĆŗÓĶ ¢ÜČó»¬ÓĶ ¢Ż»ØÉśÓĶ ¢ŽŹÆĄÆ
A.¢Ł¢Ś B.¢Ü¢Ż C.¢Ł¢Ż D.¢Ł¢Ū
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŗ£Ńó׏Ō“µÄĄūÓĆ¾ßÓŠ¹ćĄ«Ē°¾°”£
£Ø1£©ĻĀĶ¼ŹĒ“Óŗ£Ė®ÖŠĢįČ”Ć¾µÄ¼ņµ„Į÷³Ģ£ŗ
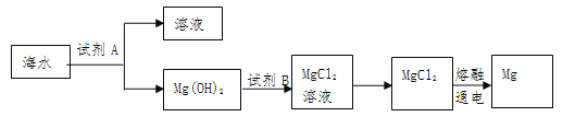
¢ŁMg(OH)2×Ŗ»ÆĪŖMgCl2µÄĄė×Ó·½³ĢŹ½ŹĒ_______________£¬
¢Ś½«MgCl2ČÜŅŗŌŚ________ĘųĮ÷ÖŠÕō·¢”¢ĄäČ“”¢½į¾§ÖʵĆMgCl2¾§Ģ唣
¢ŪÓÉĪŽĖ®MgCl2ÖĘČ”MgµÄ»Æѧ·½³ĢŹ½ŹĒ________________________”£
£Ø2£©ŗ£“ų»ŅÖŠø»ŗ¬ŅŌI£ŠĪŹ½“ęŌŚµÄµāŌŖĖŲ”£ŹµŃéŹŅĢįČ”I2µÄĶ¾¾¶ČēĻĀĖłŹ¾£ŗ

¢Ł×ĘÉÕŗ£“ųÖĮ»Ņ½żŹ±ĖłÓƵÄÖ÷ŅŖŅĒĘ÷Ćū³ĘŹĒ________________”£
¢ŚĻņĖį»ÆµÄĀĖŅŗÖŠ¼Ó¹żŃõ»ÆĒāČÜŅŗ£¬Š“³öøĆ·“Ó¦µÄĄė×Ó·½³ĢŹ½£ŗ_____________________”£
¢Ū·“Ó¦½įŹųŗó£¬æɼÓČė_________×÷ŻĶČ”¼Į£¬²ÉÓĆŻĶČ”£·ÖŅŗµÄ·½·Ø“ÓµāĖ®ÖŠĢįČ”µā”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com