
【题目】二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。
(1)科学家提出由CO2制取C的太阳能工艺如图所示。

①若“重整系统”发生的反应中n(FeO)/n(CO2)=6,则FexOy的化学式为____________。
②“热分解系统”中每分解1mol FexOy,转移电子的物质的量为________。
(2)工业上用CO2和H2反应合成二甲醚。已知:CO2(g)+ 3H2(g)═CH3OH(g)+ H2O(g) △H1=-53.7kJ/mol,CH3OCH3(g)+H2O(g) ═ 2CH3OH(g) △H2=+23.4kJ/mol,则2CO2(g)+ 6H2(g)![]() CH3OCH3(g)+3H2O(g) △H3=______kJ/mol。
CH3OCH3(g)+3H2O(g) △H3=______kJ/mol。
①一定条件下,上述合成甲醚的反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是_____(填代号)。
a.逆反应速率先增大后减小 b.H2的转化率增大
c.反应物的体积百分含量减小 d.容器中的nCO2/nH2值变小
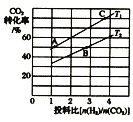
②在某压强下,合成甲醚的反应在不同温度、不同投料比时,CO2的转化率如图所示。T1温度下,将6 mol CO2和12molH2充入2L的密闭容器中,5 min后反应达到平衡状态,则0~5min内的平均反应速率v(CH3OCH3) =___;KA、KB、KC三者之间的大小关系为_____。
(3)常温下,用氨水吸收CO2可得到NH4HCO3溶液,在NH4HCO3溶液中:c (NH4+)_____c(HCO3-)(填“>”、“<”或“=”);反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K=__________________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7mol·L-1,K2=4×10-11mol·L-1)
NH3·H2O+H2CO3的平衡常数K=__________________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7mol·L-1,K2=4×10-11mol·L-1)
【答案】Fe3O4 2mol -130.8 b 0.18mol·L-1·min-1 KA=KC>KB > 1.25×10-3
【解析】
(1)①由示意图可以知道,重整系统中CO2和FeO反应生成FexOy和C,根据原子守恒确定FexOy的化学式;
②热分解系统中是FexOy分解为FeO与氧气,根据Fe元素化合价变价计算转移电子;
(2)已知:Ⅰ.CO2(g)+ 3H2(g)═CH3OH(g)+ H2O(g) △H1=-53.7kJ/mol,
Ⅱ.CH3OCH3(g)+H2O(g) ═ 2CH3OH(g) △H2=+23.4kJ/mol,
根据盖斯定律,Ⅰ×2-Ⅱ可得:2CO2(g)+ 6H2(g)![]() CH3OCH3 (g)+3H2O(g),则△H3=2△H1-△H2;
CH3OCH3 (g)+3H2O(g),则△H3=2△H1-△H2;
①a.逆反应速率先增大后减小,可能是增大生成物浓度;
b.H2的转化率增大,平衡一定正向移动;
c.反应物的体积百分含量减小,可能是增大生成物浓度等;
d.容器中的nCO2/nH2值变小,可能是减小二氧化碳的物质的量;
②T1温度下,将6 mol CO2和12molH2充入2L的密闭容器中,由图象可以知道,5 min后反应达到平衡状态时二氧化碳转化率为60%,则生成CH3OCH3为6 mol![]() 60%
60%![]() =1.8mol,根据平均反应速率v(CH3OCH3) =
=1.8mol,根据平均反应速率v(CH3OCH3) =![]() ;根据平衡常数仅与温度有关,温度不变,平衡常数不变,在相同投料比时,T1温度下二氧化碳转化率大,所以T1温度下较T2温度下正向进行程度大;
;根据平衡常数仅与温度有关,温度不变,平衡常数不变,在相同投料比时,T1温度下二氧化碳转化率大,所以T1温度下较T2温度下正向进行程度大;
(3)根据盐类水解规律,已知NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7,K2=4×10-11,所以碳酸氢根的水解程度更大;
反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K=
NH3·H2O+H2CO3的平衡常数K=![]() =
=![]() 。
。
(1)①由示意图可以知道,重整系统中CO2和FeO反应生成FexOy和C,发生的反应中n(FeO)/n(CO2)=6,根据Fe原子、O原子守恒可以知道x:y=6:(6+2)=3:4,故FexOy的化学式为Fe3O4;
因此,本题正确答案是:Fe3O4;
②热分解系统中是Fe3O4分解为FeO与氧气,分解1mol Fe3O4转移电子的物质的量为1mol![]() 3
3![]() (
(![]() -2)=2mol,
-2)=2mol,
因此,本题正确答案是:2mol;
(2)已知:Ⅰ.CO2(g)+ 3H2(g)═CH3OH(g)+ H2O(g) △H1=-53.7kJ/mol,
Ⅱ.CH3OCH3(g)+H2O(g) ═ 2CH3OH(g) △H2=+23.4kJ/mol,
根据盖斯定律,Ⅰ×2-Ⅱ可得:2CO2(g)+ 6H2(g)![]() CH3OCH3 (g)+3H2O(g),则△H3=2△H1-△H2=2
CH3OCH3 (g)+3H2O(g),则△H3=2△H1-△H2=2![]() (-53.7kJ/mol)- 23.4kJ/mol =-130.8 kJ/mol;
(-53.7kJ/mol)- 23.4kJ/mol =-130.8 kJ/mol;
因此,本题正确答案是:-130.8;
①a.逆反应速率先增大后减小,可能是增大生成物浓度,平衡逆向移动,故a错误;
b.H2的转化率增大,平衡一定正向移动,故b正确;
c.反应物的体积百分含量减小,可能是增大生成物浓度等,平衡逆向移动,故c错误;
d.容器中的nCO2/nH2值变小,可能是减小二氧化碳的物质的量,平衡逆向移动,故d错误,
故选:b;
②T1温度下,将6 mol CO2和12molH2充入2L的密闭容器中,由图象可以知道,5 min后反应达到平衡状态时二氧化碳转化率为60%,则生成CH3OCH3为6 mol![]() 60%
60%![]() =1.8mol,
=1.8mol,
所以平均反应速率v(CH3OCH3) =![]() =0.18mol·L-1·min-1;
=0.18mol·L-1·min-1;
平衡常数仅与温度有关,温度不变,平衡常数不变,所以KA=KC,在相同投料比时,T1温度下二氧化碳转化率大,所以T1温度下较T2温度下正向进行程度大,则KA=KC>KB;
因此,本题正确答案是:0.18mol·L-1·min-1;KA=KC>KB;
(3)根据盐类水解规律,已知NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7,K2=4×10-11,所以碳酸氢根的水解程度更大,所以c(NH4+) 大于c(HCO3-);反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K=
NH3·H2O+H2CO3的平衡常数K=![]() =
=![]() =
=![]() =1.25
=1.25![]() 10-3;
10-3;
故答案为:>;1.25×10-3;


科目:高中化学 来源: 题型:
【题目】丁达尔效应在日常生活中随处可见,下列情况下不能观察到丁达尔效应的是( )
A.光线透过树叶间的缝隙射入密林中
B.雾天时,打开汽车雾灯
C.日光从窗隙射入暗室
D.用激光笔照射玻璃杯中的蔗糖水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸是生物油的主要成分之一,乙酸制氢具有重要意义:
热裂解反应CH3COOH(g)→2CO(g)+2H2(g) △H=+2l3.7KJ·mol-1
脱酸基反应CH3COOH(g)→CH4(g)+CO2(g) △H=-33.5KJ·mol-1
(1)请写出CO与H2甲烷化的热化学方程式_________________________________。
(2)在密闭容器中,利用乙酸制氢,选择的压强为___________(填“较大”或“常压”)。其中温度与气体产率的关系如图:

①约650℃之前,脱酸基反应活化能低速率快,故氢气产率低于甲烷;650℃之后氢气产率高于甲烷,理由是随着温度升高后,热裂解反应速率加快,同时______________________。
②保持其他条件不变,在乙酸气中掺杂一定量水,氢气产率显著提高而CO的产率下降,请用化学方程式表示:_________________________________。
(3)若利用合适的催化剂控制其他的副反应,温度为TK时达到平衡,总压强为PkPa,热裂解反应消耗乙酸20%,脱酸基反应消耗乙酸60%,乙酸体积分数为___________(计算结果保留l位小数);脱酸基反应的平衡常数Kp为___________kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某次实验需用0.6mol·L-1 NaOH溶液480 mL。配制方法如下:
(1)配制该溶液应选用_______________mL容量瓶;
(2)用托盘天平准确称量__________g 固体NaOH;
(3)将称量好的NaOH固体放在500 mL大烧杯中,倒入约200 mL蒸馏水,用玻璃棒搅拌,使固体全部溶解,待__________________后,将烧杯中的溶液注入容量瓶中;
(4)用少量蒸馏水洗涤烧杯___________次,洗涤后的溶液___________________,轻轻晃动容量瓶,使溶液混合均匀;
(5)向容量瓶中加入蒸馏水,到液面______________时,改用___________加蒸馏水至液面最低点与刻度线相切。盖好瓶塞,______________;
(6)若在配制过程中出现下列情况,将使所配制的NaOH溶液的浓度偏高的是__________,偏低的是__________,对实验结果没有影响的是_______(填各选项的序号)。
A.所用的NaOH中混有少量Na2CO3
B.用托盘天平称量一定质量固体NaOH时,所用的小烧杯内壁不太干燥
C.配制溶液所用的容量瓶洗净后没有烘干
D.固体NaOH在烧杯中溶解后,立即将溶液转移到容量瓶内并接着进行后续操作
E.转移溶液后,未洗涤烧杯和玻璃棒就直接定容
F.最后确定NaOH溶液体积(定容)时,俯视观察液面与容量瓶刻度线
G.定容摇匀后静止,发现液面低于刻度线,再加蒸馏水至刻度线。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列化合物:①NaCl、②NaOH、③HCl、④NH4Cl、⑤CH3COONa、⑥CH3COOH、⑦NH3·H2O、⑧H2O。回答下列问题。
(1)NH4Cl溶液显__________性,用离子方程式表示原因 , 其溶液中离子浓度大小顺序为_________
(2)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH-)=__________mol/L在pH=3的CH3COOH溶液中,水电离出来的c(H+)=__________mol/L。
(3)已知纯水中存在如下平衡:H2O![]() H++OH- △H>0,现欲使平衡向右移动,且所得溶液显酸性,可选择的方法是_____________(填字母序号)。
H++OH- △H>0,现欲使平衡向右移动,且所得溶液显酸性,可选择的方法是_____________(填字母序号)。
A.向水中加入NaHSO4固体 B.向水中加Na2CO3固体
C.加热至100℃ D.向水中加入(NH4)2SO4固体
(4)若将等pH、等体积的②NaOH和⑦NH3·H2O分别加水稀释m倍、n倍,稀 释后两种溶液的pH仍相等,则m__________n(填“<”、“>”或“=”)。
(5)①NaCl、②NaOH、③HCl、⑤CH3COONa、⑥CH3COOH,这5种溶液的物质的量浓度相同,则这5种溶液按 pH由大到小的顺序为:______________(填序号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】其他条件不变,增大反应物的浓度能增大反应速率的原因是
A. 单位体积内分子数增多 B. 单位体积内活化分子数增多
C. 活化分子百分数增大 D. 单位体积内有效碰撞的次数增多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两种固体纯净物的溶解度曲线如图所示。在常温下,先在两支试管里分别装入甲、乙两种物质的饱和溶液(试管底部均有未溶解的固体),再放进盛有冰水的烧杯里。下列说法正确的是( )


A. 乙溶液中溶质的质量分数增大
B. 装甲溶液的试管中剩余的固体减少
C. 试管里甲、乙物质的溶解度都增大
D. 两支试管里剩余的固体都增多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂—铜空气燃料电池(如图)容量高、成本低,该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为:2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法错误的是
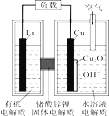
A. 整个反应过程中,氧化剂为O2
B. 放电时,正极的电极反应式为:Cu2O+H2O+2e-=2Cu+2OH-
C. 放电时,当电路中通过0.1 mol电子的电量时,有0.1 mol Li+透过固体电解质向Cu极移动,有标准状况下1.12 L氧气参与反应
D. 通空气时,铜被腐蚀,表面产生Cu2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是:
A. 反应达到平衡时,X的转化率为50% B. 反应可表示为X+3Y![]() 2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数
2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com