
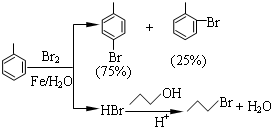
| 物质 | 甲苯 | 1-丙醇 | 1-溴丙烷 |
| 沸点℃ | 110.8 | 97.2 | 71 |
| 物质 | 对溴甲苯 | 邻溴甲苯 | |
| 沸点℃ | 184.3 | 181.7 | |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、该反应是置换反应 |
| B、CCl4是一种化合物 |
| C、制造过程中元素的种类没有改变 |
| D、金刚石属于金属单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 组别 | 起始浓度c/mol?dm3 | 平衡浓度c/mol?dm3 | K | 温度T | ||||
| H2 | N2 | NH3 | H2 | N2 | NH3 | |||
| 实验1 | 1.9868 | 1.356 | 0 | 1.35 | 1.15 | 0.412 | 5.98×10-2 | T1 |
| 实验2 | 0.6405 | 1.0435 | 0 | C1 | C2 | C3 | K2 | T1 |
| 实验3 | 0.6405 | 1.0435 | 0 | 0.51 | 1.00 | 0.087 | 6.05×10-2 | T2 |
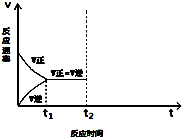
查看答案和解析>>
科目:高中化学 来源: 题型:
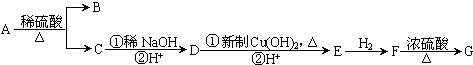
查看答案和解析>>
科目:高中化学 来源: 题型:
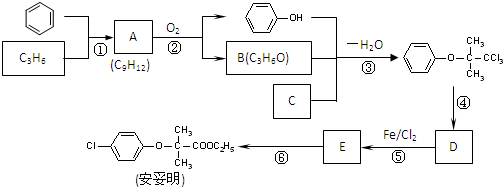
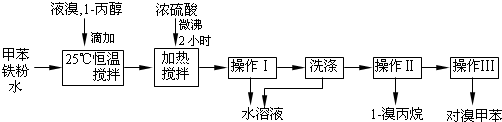
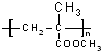 (用反应流程图表示,无机试剂任选,并注明反应条件).
(用反应流程图表示,无机试剂任选,并注明反应条件).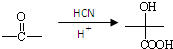
| 浓硫酸 |
| 170℃ |
| Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
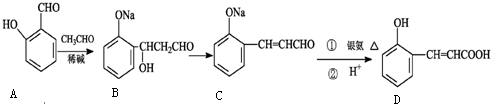
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该溶液的pH值一定等于1 |
| B、阴离子肯定有I-,不能确定有无HCO3- |
| C、阳离子肯定没有Fe3+,一定有Na+ |
| D、该溶液含有的溶质成分可能为HI或HI和NaI或NaI和NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 离子 | Cu2+ | Al3+ | H+ | Cl- | SO42- |
| c(mol?L-1) | 1 | 1 | 2 | 5 | a |
| A、反应中共转移0.9 mol电子 |
| B、铝元素以Al(OH)3的形式存在 |
| C、阴极质量增加3.2 g |
| D、a=2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com