
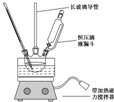
 �����������һ����Ҫ�Ĺ�ҵԭ�ϣ�ij��ѧС�������ͼװ���Ա����ᡢ�״�Ϊԭ����ȡ������������й����ʵ��������ʼ��±���ʾ��
�����������һ����Ҫ�Ĺ�ҵԭ�ϣ�ij��ѧС�������ͼװ���Ա����ᡢ�״�Ϊԭ����ȡ������������й����ʵ��������ʼ��±���ʾ��| ������ | �״� | ��������� | |
| �۵�/�� | 122.4 | -97 | -12.3 |
| �е�/�� | 249 | 64.3 | 199.6 |
| �ܶ�/g��cm-3 | 1.2659 | 0.792 | 1.0888 |
| ˮ���� | �� | ���� | ���� |

���� �ϳɱ���������ֲ�Ʒ
��1���л����ӷ���B��������������������������ԭ��ͨ������ˮ��
��2���úϳɷ�Ӧ�ǿ��淴Ӧ���״��ȱ�����������Ҽ״��е�ͣ�����ʧ�����Ӽ״�Ͷ������߲��ʣ�
�ֲ�Ʒ�ľ��ƣ��ֲ�Ʒ���Լ�1Ϊ̼������Һϴ�ӱ���������й������ᣬͨ����Һ�õ��л��㣬����õ�������������״���ˮ��
��1��������ͼ��֪������1��ϴȥ����������е����ᡢ�����
��2������2��ȡ����ķ������������������״���ˮ���룬�ɱ���������ķе��֪Ӧ�ռ��е�199.6�����֣�
��3��������ת����Ϊa�����ݹ�ϵʽC7H6O2��C8H8O2���������ȹ�ϵ�з��̼��㣻
��4������ʱ��100�濪ʼ�ռ���Ʒ�����ռ���ˮ�֣����������������Ӧƫ�״������������߱������ת���ʣ��Ʊ���Ʒʱ�����ᱻ������������������ʽ��ͣ�
��� �⣺�ϳɱ���������ֲ�Ʒ
��1���л����ӷ���B��������������������������ԭ��ͨ������ˮ��Ӧ��b��ͨ������ˮ��
�ʴ�Ϊ������������b��
��2���úϳɷ�Ӧ�ǿ��淴Ӧ���״��ȱ�����������Ҽ״��е�ͣ�����ʧ�����Ӽ״�Ͷ������߲��ʣ���ʵ�����ù����ķ�Ӧ��״���
�ʴ�Ϊ���úϳɷ�Ӧ�ǿ��淴Ӧ���״��ȱ�����������Ҽ״��е�ͣ�����ʧ�����Ӽ״�Ͷ������߲��ʣ���߱������ת���ʣ�
�ֲ�Ʒ�ľ��ƣ�
��1��������ͼ��֪������1��ϴȥ����������е����ᡢ�����ᣬӦѡ��̼������Һ��
�ʴ�Ϊ��B��ϴȥ����������й������
��2������2��ȡ����ķ������������������״���ˮ���룬�ɱ���������ķе��֪Ӧ�ռ��е�199.6�����֣���Ӧ�����¶�199.6�棬
�ʴ�Ϊ��199.6��
��3��0.1mol�����������Ϊ0.1mol��122g/mol=12.2g��������ת����Ϊa����
C7H6O2������C8H8O2
122 136
12.2g��a 10g
���ԣ�122��12.2a g=136��10g�����a=73.5%��
�ʴ�Ϊ��73.5%��
��4��A������ʱ��100�濪ʼ�ռ���Ʒ�����ռ���ˮ�֣����������������Ӧƫ����������IJ���Ӧ�������۲�������A�����ϣ�
B���״������������߱������ת���ʣ�����������IJ���Ӧ����B�����ϣ�
C���Ʊ���Ʒʱ�����ᱻ������������������ʽ��ͣ����±���������IJ������ͣ���C���ϣ�
�ʴ�Ϊ��C��
���� ���⿼���л���ĺϳɣ����ضԻ�ѧʵ��Ŀ��飬�漰��װ�õ����⡢���ʵķ����ᴿ����ʵ�������Ŀ��ơ������ݵķ��������ȣ��Ѷ��еȣ���Ҫѧ������֪ʶ�Ļ������������������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �˳�����Mg��OH��2��Ca��OH��2�Ļ���� | |
| B�� | �˳���ֻ��Mg��OH��2 | |
| C�� | ���˺���Һ�д���Ca2+��Mg2+ | |
| D�� | ��ԭ��Һ�м���8.8 g NaOH���壬������ʹCa2+����ת��Ϊ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ڢ� | B�� | �٢ۢ� | C�� | �٢� | D�� | �ڢۢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ����������Ҫ�ľ�ϸ����ԭ�ϣ���ҽҩ��Ⱦ�ϵ��м��壬�������л��ܼ����Ʊ��������Ĺ������£�
����������Ҫ�ľ�ϸ����ԭ�ϣ���ҽҩ��Ⱦ�ϵ��м��壬�������л��ܼ����Ʊ��������Ĺ������£� +HNO3��Ũ��$\frac{50��60��}{98%Ũ{H}_{2}S{O}_{4}}$+
+HNO3��Ũ��$\frac{50��60��}{98%Ũ{H}_{2}S{O}_{4}}$+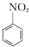 +H2O
+H2O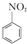 +HNO3��Ũ��$\frac{95%}{98%Ũ{H}_{2}S{O}_{4}}$
+HNO3��Ũ��$\frac{95%}{98%Ũ{H}_{2}S{O}_{4}}$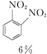 +
+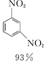 +
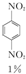
+
| ���� | �۵�/�� | �е�/�� | �ܶȣ�20�棩/g•cm-3 | �ܽ��� |
| �� | 5.5 | 80 | 0.88 | ����ˮ |
| ������ | 5.7 | 210.9 | 1.205 | ������ˮ |
| 1��3�������� | 89 | 301 | 1.57 | ����ˮ |
| Ũ���� | - | 83 | 1.4 | ������ˮ |
| Ũ���� | - | 338 | 1.84 | ������ˮ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��1-�������廯�ƺͽ�ŨH2SO4�����Ϊԭ�ϣ���ʵ�����Ʊ�1-�嶡�飬�����鷴Ӧ�IJ��ָ��������֪��NaCl+H2SO4��Ũ��=NaHSO4+HCl�������������װ�ã����мг�������������������ȴˮ��û�л�������ش��������⣺
��1-�������廯�ƺͽ�ŨH2SO4�����Ϊԭ�ϣ���ʵ�����Ʊ�1-�嶡�飬�����鷴Ӧ�IJ��ָ��������֪��NaCl+H2SO4��Ũ��=NaHSO4+HCl�������������װ�ã����мг�������������������ȴˮ��û�л�������ش��������⣺| ���� | �۵�/0C | �е�/0C |
| 1-���� | -89.5 | 117.3 |
| 1-�嶡�� | -112.4 | 101.6 |
| ���� | -95.3 | 142.4 |
| 1-��ϩ | -185.3 | -6.5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
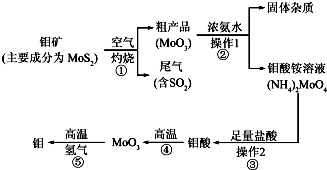
| ��ѧʽ | ���볣�� |
| H2SO3 | K1=1.3��10-2��K2=6.2��10-8 |
| H2CO3 | K1=4.3��10-7��K2=5.6��10-11 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ƿ������ˮϴ�Ӻ�ֱ��ʢ������Һ | |
| B�� | �к͵ζ���Ҫ�ﵽ�ζ��յ�ʱ���۾�ע�ӵζ�����Һ���λ�ñ仯 | |
| C�� | �ζ���װ��Һǰδ�ñ���Һ��ϴ | |
| D�� | �ζ�ʱ����ƿҡ��̫���ң���������Һ���� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com