
【题目】下列计算结果正确是( )
A. 0.5L、8mol/L 浓盐酸与足量MnO2完全反应产生22.4L(标准状况下)Cl2
B. 2H2S+SO2═3S↓+2H2O反应中氧化产物与还原产物的物质的量之比为1:2
C. 将NO2和O2等体积混合充满一试管,倒置于水槽中,充分反应后,试管中剩余气体占试管容积的![]()
D. 标准状况下,用一充满HCl气体的干燥烧瓶做喷泉实验,当水充满整个烧瓶后(假设溶液不外溢),烧瓶内盐酸的物质的量的浓度为![]() mol/L
mol/L
【答案】D
【解析】
A.0.5L、8mol/L的浓盐酸含有4mol氯化氢,完全反应生成1mol氯气,但是浓盐酸变成稀盐酸,反应停止,生成的氯气小于1mol,生成Cl2的分子数小于NA,故A错误;
B.该反应中S元素化合价由-2价、+4价变为0价,所以S既是氧化产物又是还原产物,氧化产物和还原产物的物质的量之比为2:1,故B错误;
C.根据4NO2+O2+2H2O══4HNO3可知,O2过量。设NO2和O2的体积各1L,则1LNO2消耗O21/4L,剩余O23/4L,所以3/4×1/2=3/8,所以试管中剩余气体占试管容积的3/8,故C错误;
D.令烧瓶的容积为VL,则氨气的体积为VL,氨气的物质的量为VL/22.4L/mol=V/22.4mol,氨水溶液的物质的量浓度为V/22.4mol/VL=1/22.4mol/L,故D正确。
故选D。


科目:高中化学 来源: 题型:
【题目】Cl2常用作自来水消毒剂,Cl2作消毒剂时生成的有机氯化物可能对人体有害。ClO2被世界卫生组织(WHO)列为A级高效、安全灭菌消毒剂,将逐渐取代Cl2成为自来水的消毒剂。某小组探究“地康法制氯气”的原理并验证Cl2的性质,设计实验如下(夹持装置略去)。请回答下列问题:

(1)A装置中反应利用了浓硫酸的难挥发性,则该反应的化学方程式为______________。
(2)当B装置中反应转移0.08 mol电子时,则消耗的Na2O2固体的质量为______________。
(3)反应开始后,硫酸铜变蓝,则装置D中发生反应的化学方程式为 ______________ 。
(4)ClO2的制备方法比较实用的有数十种,下列方法是常见方法之一。
方法一:2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2H2O。当有0.4 mol电子发生转移时,得到的还原产物为______________mol。
方法二:实验室常用氯酸钾(KClO3)、草酸(H2C2O4)和硫酸溶液共热制备。
有同学设计如下装置制备ClO2并用其处理含锰离子的工业废水。
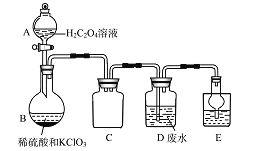
①C装置的作用为______________。
②B中反应产物有ClO2、CO2等,发生氧化反应的过程为:______________ → ______________ (用化学式表示)。______________
③写出装置D中除去Mn2+(已知Mn2+转化为MnO2)的离子方程式:______________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜的相关化合物在生产生活中具有重要的作用。回答下列问题:
(1)铜元素在周期表中的位置是______________,基态铜原子中,核外电子占据最高能层的符号是_________________,占据该最高能层的电子数为__________________。
(2)在一定条件下,金属相互化合形成的化合物称为金属互化物,如Cu9Al4、Cu5Zn8等。某金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于__________(填“晶体”或“非晶体”)。
(3)铜能与类卤素[(SCN)2]反应生成Cu(SCN)2,1mol(SCN)2分子中含有σ键的数目为______________。 (SCN)2对应的酸有硫氰酸(H-S-C![]() N)、异硫氰酸(H-N=C=S)两种。理论上前者沸点低于后者,其原因是____________________________。
N)、异硫氰酸(H-N=C=S)两种。理论上前者沸点低于后者,其原因是____________________________。
(4)铜晶体中铜原子的堆积方式为面心立方堆积,每个铜原子周围距离最近的铜原子个数为________。
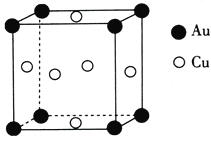
(5)铜与金形成的金属互化物的晶胞结构如图所示,其晶胞边长为a nm,该金属互化物的密度为____________(用含a、NA的代数式表示)g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验中需2 mol·L-1的碳酸钠溶液950 mL,配制时应选用的容量瓶的规格是
A. 1 000 mL B. 950 mL C. 900 mL D. 500 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下图所示化合物的说法不正确的是

A. 既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应
B. 既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体。
C. 既可以催化加氢,又可以使酸性KMnO4溶液褪色
D. 1 mol该化合物最多可以与3 mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国清代《本草纲目拾遗》中记叙无机药物335种,其中“强水”条目下写道:“性最烈,能蚀五金…其水甚强,五金八石皆能穿第,惟玻璃可盛.”这里的“强水”是指( )
A. 氨水 B. 硝酸 C. 酒 D. 卤水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种广谱、高效的消毒剂,易溶于水,尤其在水处理等方面有广泛应用。以下是某校化学研究小组设计实验室制取ClO2的工艺流程图。下列有关说法正确的是 ( )

A. 电解时发生反应的化学方程式为2HCl![]() Cl2↑+H2↑
Cl2↑+H2↑
B. 由NaClO2溶液制取0.6 mol ClO2时,至少消耗0.1 mol NCl3
C. 将产生的混合气体通过盛有碱石灰的干燥器以除去ClO2中的NH3
D. 溶液X的主要成分为NaClO2和NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X、Y、Z、M、N、O均为短周期主族元素,且原子序数依次增大。已知X常见离子相当于一个裸露的质子,Y元素原子最外层电子数与核外电子总数之比为3∶4,N元素原子的最外层电子数与次外层电子数之比为3∶4,Z、M、O位于同一周期,三种元素原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水.
据此回答下列问题:
(1)写出下列元素的符号:X________;Z________;M_________;N___________。
(2)X与Y可分别形成10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式:_______(分解反应)。
(3)X、Z可以形成一种离子化合物,在该化合物中Z为+1价,可以和水反应生成氢气,写出该化合物和水反应的化学方程式:____。
(4)Z、M两种元素最高价氧化物的水化物之间反应的化学方程式为_____。
(5)下列事实能说明元素O的非金属性比元素N的非金属性强的是_______。
a.元素O形成的单质比元素N形成的单质的熔点低
b.O和N两元素的简单氢化物受热分解,前者的分解温度高
c.O2通入到X2N的溶液中出现浑浊
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com