
【题目】下图1为实验室制取氨的实验装置。

(1)写出A中所发生反应的化学方程式________________________。
(2)该装置还可以制备哪些气体________;试管口略向下倾斜的原因是__________。
(3)在收集氨气时,试管口一团棉花的作用是_________________________。
(4)一位学生用制得的氨,按上图2装置进行喷泉实验,烧瓶已充满干燥的氨气,引发喷泉实验的操作是_____________________________。
(5)另一学生积极思考产生喷泉的其他方法,设计上图3装置。
①首先在锥形瓶中分别加入足量的下列物质,反应后产生喷泉的是_____________。
A.碳酸钙粉末和浓盐酸
B.碳酸氢铵溶液与稀氢氧化钠溶液
C.氯化氢和硝酸银溶液
D.氯化氢和酚酞溶液
②该同学又向锥形瓶中加入酒精,水槽加入冷水后,再加入足量的下列物质,结果也产生了喷泉。水槽中加入的物质可以是____________。
A.硝酸铵 B.食盐 C.浓硫酸 D.硫酸铜
【答案】2NH4Cl+2Ca(OH)2![]() CaCl2+2NH3↑+2H2O 氧气 为防止生成的水倒流至试管底部,使试管受热不均而炸裂 防止氨气和空气对流,使收集的氨气不纯 打开橡皮管的夹子,挤压胶头滴管的胶头,使少量的水进入烧瓶 A C
CaCl2+2NH3↑+2H2O 氧气 为防止生成的水倒流至试管底部,使试管受热不均而炸裂 防止氨气和空气对流,使收集的氨气不纯 打开橡皮管的夹子,挤压胶头滴管的胶头,使少量的水进入烧瓶 A C
【解析】
(1)实验室利用熟石灰和氯化铵加热制备氨气,据此解答;
(2)根据装置特点分析判断;根据反应中有水生成分析判断;
(3)根据氨气的性质解答;
(4)利用氨气极易溶于水,形成压强差而形成喷泉进行解答;
(5)依据加入的物质能导致锥形瓶中气压变大的原理才能产生喷泉,结合物质的性质分析解答。
(1)装置采用的是固+固混合加热制气的方法,故用氯化铵和氢氧化钙固体混合加热制NH3,氯化铵与氢氧化钙反应生成氯化钙、氨气和水,反应的化学方程式为2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
(2)装置采用的是固+固混合加热制气的方法,因此该装置还可以制备氧气;由于反应中有水生成,因此为防止生成的水倒流至试管底部,使试管受热不均而炸裂,因此试管口要略向下倾斜。
(3)收集氨气用的是向下排空气法,试管口棉花的作用是减少氨气与空气的对流,加快收集的速率,同时保证试管中能收集满氨气。
(4)氨气极易溶于水,如果打开止水夹,氨气溶于水后烧瓶内压强迅速减小,而形成喷泉,故引发喷泉实验的操作是:打开橡皮管的夹子,挤压胶头滴管的胶头,使少量的水进入烧瓶;
(5)A.CaCO3粉末和浓盐酸反应产生大量二氧化碳,使锥形瓶中压强增大,形成喷泉,A符合;
B.碳酸氢铵溶液与稀氢氧化钠溶液反应不能产生氨气,不能形成喷泉,B不符合;
C.氯化氢和硝酸银溶液反应,但不产生气体,不能形成喷泉,C不符合;
D.HCl和酚酞溶液混合不产生气体,不能形成喷泉,D不符合;
答案选A;
②锥形瓶内装有酒精,易挥发,要形成喷泉,应使锥形瓶内压强增大,所加物质应放出大量的热,浓硫酸遇水被稀释,释放出大量的热,使锥形瓶中的乙醇挥发,压强增大,形成喷泉,而其它物质都不能达到溶于水而放出大量热的目的,只有C符合,答案选C。


科目:高中化学 来源: 题型:
【题目】将铜片放入0.1mol·L-1FeCl3溶液中,反应一段时间后取出铜片,溶液中![]() ,则反应后溶液中
,则反应后溶液中![]() 与
与![]() 的物质的量之比为 ( )
的物质的量之比为 ( )
A. 3:2 B. 3:4 C. 3:5 D. 4:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化钠(NaN3)是汽车安全气囊最理想的气体发生剂原料。下面是工业水合肼法制备叠氮化钠的工艺流程;

已知NaN3能与AgNO3反应生成白色难溶于水的AgN3;有关物质的物理性质如下表:
熔点℃ | 沸点℃ | 溶解性 | ||
CH3OH | —9 | 64.7 | 与水互溶 | |
水合肼(N2H4H2O) | 2 | 113.5 | 与水、醇互溶, 不溶于乙醚和氯仿 | |
亚硝酸甲酯(CH3ONO) | —17 | —12 | 溶于乙醇、乙醚 |
请回答:
(1)步骤Ⅰ中NaNO2与稀硫酸发生副反应生成两种气体(其中一种气体在空气中可以转化为另一种气体)的离子方程式为___________;步骤Ⅱ中生成NaN3的化学方程式为_______。
(2)实验室模拟步骤Ⅱ实验装置如下图(装置中冷却水省略,下同):
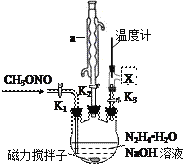
①仪器a的名称__________________,作用是________________________________。
②根据实验发现温度在20℃左右反应的选择性和转化率最高,但是该反应属于放热反应,因此可以采取的措施是______________________________。
③图中X处连接的最合适装置应为下图中的_________。
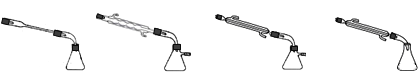
A B C D
(3)步骤Ⅱ、Ⅲ中制备叠氮化钠并对溶液A进行蒸馏的合理操作顺序是__________。
①打开K1、K2,关闭K3 ②打开K3 ③加热 ④关闭K1、K2
(4)步骤Ⅳ对溶液B加热蒸发至溶液体积的1/3,NaN3结晶析出。
①步骤Ⅴ可以用______________洗涤晶体。
A.水 B.乙醇 C.乙醇水溶液 D.乙醚
②沉淀滴定法测定产品纯度,是以淡黄色K2CrO4溶液作指示剂,将AgNO3标准溶液滴入样品溶液,至少量Ag2CrO4出现,即溶液呈淡红色为终点。AgNO3溶液要装在棕色的酸式滴定管里进行滴定,理由是_____________。下列操作合理的是______。
A.滴定管和移液管管尖不可接触锥形瓶内壁
B.滴定时滴液速度应先快后慢,接近终点时一滴一摇
C.滴定过程中可用蒸馏水将锥形瓶壁上粘附的溶液冲下
D.若未等滴定管液面稳定就读数会导致测定结果偏高
E.若发现滴液过量,可回滴样品溶液,至红色褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pOH= -lgc(OH-)。298 K时,向20.00 mL0.10mol·L-1氨水中滴入0.10 mol·L-1的盐酸,溶液的pH和pOH与加入盐酸体积关系如图所示。下列说法正确的是
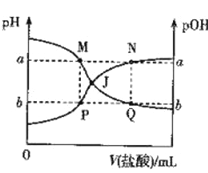
A. 曲线PJN表示溶液中PH的变化
B. M点水的电离程度比Q点大
C. M、P两点的数值之和a + b = 14
D. pH与pOH交叉点J对应的V(盐酸)=20.00 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验中不小心将几滴新制氯水滴入盛有溴化亚铁溶液的试剂瓶中,发现溶液变成了黄色,根据已有化学知识,请你参与上述现象形成原因的分析与探究:
(1)提出问题猜想:
猜想一:溶液呈黄色是因发生离子反应①_________________________________________(填离子方程式)所致。
猜想二:溶液呈黄色是因发生离子反应②______________________________________(填离子方程式)所致。
(2)设计实验并验证
为验证①与②中是哪个原因导致了溶液变黄色,设计并进行了以下实验。请根据以下所给试剂,进行合理选用,完成实验方案1和方案2:__________________、______________、__________________、______________。

(3)实验结论:以上实验不仅验证了溶液变黄的真实原因,同时证明了Fe2+的还原性比Br-______________(填“强”或“弱”)。
(4)实验反思
Ⅰ.根据上述实验推测,若在溴化亚铁溶液中滴入足量氯水,再加入CCl4并充分振荡后静止,产生的现象是______________________________________。
Ⅱ.在100 mL FeBr2溶液中通入2.24 L Cl2(标准状况),溶液中有1/2的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙两种物质:

(1)乙中含有的官能团的名称为__________________(不包括苯环)。
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):
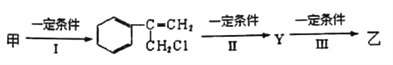
反应I的化学其中反应I的反应类型是____________________,反应II的条件是________,反应III的化学方程式为_________________(不需注明反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数。下列说法正确的是
A. 适量Na2O2溶于水充分反应,生成0.1mol O2,则电子转移数目为0.4NA
B. 1mol氨基(-NH2)中含有电子的数目为9NA
C. 42g有机物C3H6中含有双键数目为NA
D. 1mol/L的NaClO溶液中含有ClO-的数目小于NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某兴趣小组根据教材中实验设计的一个能够说明碳酸钠与碳酸氢钠热稳定性的套管实验,请观察图示实验装置结合相关实验原理,判断下列有关的说法和做法其中不科学的是( )
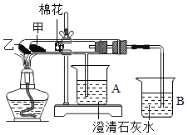
A. 甲为小苏打,乙为纯碱
B. 若要证明干燥碳酸氢钠受热分解能产生水,可以在小试管内塞上蘸有无水硫酸铜粉末的棉花球
C. 加热不久就能看到A烧杯的澄清石灰水变浑浊
D. 整个实验过程中都没有发现A烧杯的澄清石灰水变浑浊
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com