
| A. | 容器内压强不随时间变化 | |
| B. | 容器内各物质的浓度不随时间变化 | |
| C. | 容器内O2、NO、NO2的浓度之比为1:2:2 | |
| D. | 单位时间内生成1mol O2,同时生成0.2mol NO2 |
分析 可逆反应达到平衡状态时,正逆反应速率相等但不等于0,反应体系中各物质的物质的量、物质的量浓度、百分含量以及由此引起的一系列物理量不变,据此判断.
解答 解:A.该反应是一个反应前后气体体积减小的可逆反应,当容器内压强不随时间变化时,正逆反应速率相等,该反应达到平衡状态,故A不选;
B.当容器内各物质的浓度不随时间变化时,正逆反应速率相等,该反应达到平衡状态,故B不选;
C.容器内O2、NO、NO2的浓度之比为1:2:2,该反应可能达到平衡状态,也可能没有达到平衡状态,与反应初始浓度及转化率有关,故C选;
D.单位时间内生成1mol O2,同时生成0.2mol NO2,也同时消耗1mol O2,正逆反应速率相等,该反应达到平衡状态,故D不选;
故选C.
点评 本题考查化学平衡状态判断,为高频考点,“只有反应前后改变的物理量”才能作为判断依据,反应前后改变的物理量不变时可逆反应就达到平衡状态,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 酸性强弱:HIO4>HBrO4 | B. | 原子半径大小 Na>S>O | ||
| C. | 碱性强弱KOH>NaOH | D. | 金属性强弱Na>Mg>Al |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 | |
| B. | 向氯水中加CaCO3后,溶液漂白性增强 | |
| C. | 将氯化铁溶液加热蒸干最终得不到氯化铁固体 | |
| D. | 增大压强,有利于SO2和O2反应生成SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁沈阳东北育才学校高一阶段考一化学卷(解析版) 题型:选择题
NA为阿伏伽德罗常数的值,下列叙述错误的是( )
A.18 g H2O中含的 质子数为10 NA
质子数为10 NA
B.12 g  金刚石含有的电子数为4 NA
金刚石含有的电子数为4 NA
C.46 g NO2和N2O4混合气体中含有原子总数为3 NA
D.23 g Na 与足量 O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子数相同的N2和C2H6 | B. | 等体积等密度的CO和N2 | ||
| C. | 等体积的O2和N2 | D. | 质量相等的N2和CO2 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁沈阳东北育才学校高二阶段考一化学卷(解析版) 题型:选择题
在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒 容,测得反应达到平衡时的有关数据如下(已知N2(g)+3H2(g)
容,测得反应达到平衡时的有关数据如下(已知N2(g)+3H2(g)  2NH3(g)
2NH3(g)  kJ·mol
kJ·mol )
)
容器 | 甲 | 乙 | 丙 |
| 1mol N2、3mol H2 | 2mol NH3 | 4mol NH3 |
NH3的浓度(mol/L) | c1 | c2 | c3 |
反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ |
体系压强(pa) | p1 | p2 | p3 |
反应物转化率 | α1 | α2 | α3 |
请写出下列物理量的关系:
(1)浓度c1与c2_________________;2c2与c3________________
(2)能量a与b __________________;2b与c___________________
(3)压强p1与p2_________________;2p2与p3__________________
(4)转化率α1与α2________________;α2与α3___________________
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
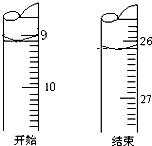 盐酸和氢氧化钠是工业上重要的化工原料,也是实验室里常见的试剂.
盐酸和氢氧化钠是工业上重要的化工原料,也是实验室里常见的试剂.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com