
| A. | ①②⑤ | B. | ③④⑥ | C. | ③④⑤⑥ | D. | ②③④ |
分析 ①活化分子间有合适的取向,发生的碰撞才能发生化学反应;
②普通分子间的碰撞不可能发生化学反应;
③升高温度使部分非活化分子转化为活化分子;
④增大反应物浓度会加快反应速率,增大单位体积内活化分子个数;
⑤使用催化剂能提高反应速率,催化剂能降低反应所需活化能;
⑥化学反应的实质是旧化学键的断裂和新化学键的形成.
解答 解:①活化分子间有合适的取向,发生的碰撞一定能发生化学反应,故①错误;
②普通分子间不可能发生化学反应,故②错误;
③升高温度会加快反应速率,原因是部分非活化分子吸收能量后转化为活化分子,所以增加了活化分子百分数,从而导致化学反应速率加快,故正确;
④增大反应物浓度导致单位体积内活化分子个数增多,所以单位体积内有效碰撞的次数增多,则会加快反应速率,故正确;
⑤使用催化剂能提高反应速率,降低活化能,使部分非活化分子转化为活化分子,所以使有效碰撞频率增大,故错误;
⑥化学反应的实质是旧化学键的断裂和新化学键的形成过程,即活化分子有合适取向时的有效碰撞,故正确;
故选B.
点评 本题考查影响化学反应速率的因素,为高频考点,把握活化分子理论为常见的影响反应速率的因素为解答的关键,侧重理论的理解和分析,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | XeF4分子具有非常好的热稳定性 | |
| B. | XeF4分子中Xe的化合价为0价 | |
| C. | 氧化剂和还原剂的物质的量之比为2:3 | |
| D. | 每生成4molXe转移16mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室制氢气,为了加快反应速率,可向稀 H2SO4 中滴加少量 Cu(NO3)2 溶液 | |
| B. | N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变升高温度,平衡时氢气转化率增大 | |
| C. | 吸热反应“TiO2(s)+2Cl2(g)═TiCl4(g)+O2(g)”在一定条件下可自发进行,则该反 应的△S<0 | |
| D. | 为处理锅炉水垢中的 CaSO4,可先用饱和 Na2CO3 溶液浸泡,再加盐酸溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 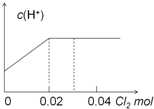 | B. | 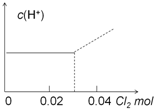 | ||
| C. | 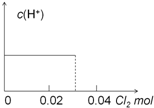 | D. | 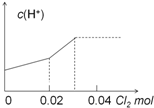 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验 | 现象 | 结论 |
| A | 取少量食盐溶于水,加稀硫酸酸化,再滴入淀粉溶液 | 溶液未呈蓝色 | 该食盐中不含有碘酸钾 |
| B | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡、静置 | 下层溶液显紫红色 | Fe3+的氧化性大于I2 |
| C | 向蛋白质溶液中加入CuCl2或(NH4)2SO4饱和溶液 | 均有沉淀 | 蛋白质均发生了变性 |
| D | 将0.1mol•L-1 MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol•L-1CuSO4溶液 | 白色沉淀逐渐变为蓝色沉淀 | Ksp[Cu(OH)2]< Ksp[Mg(OH)2] |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的单质一定是由还原该元素的化合物来制得 | |
| B. | 含有最高价元素的化合物不一定具有很强的氧化性 | |
| C. | 阳离子只能得到电子被还原,阴离子只能失去电子被氧化 | |
| D. | 在化学反应中,得电子越多的氧化剂,其氧化性就越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{8b-3a}{2V}$mol•L-1 | B. | $\frac{8b-3a}{V}$mol•L-1 | C. | $\frac{a-2b}{V}$mol•L-1 | D. | $\frac{a-2b}{2V}$mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在体积恒定的密闭容器中发生反应N2O4(g)?2NO2(g)△H(△H>0),在温度为T1、T2时,平衡体系中NO2的体积分数随压强的变化曲线如图所示.下列说法正确的是( )
在体积恒定的密闭容器中发生反应N2O4(g)?2NO2(g)△H(△H>0),在温度为T1、T2时,平衡体系中NO2的体积分数随压强的变化曲线如图所示.下列说法正确的是( )| A. | A、C两点的反应速率:A>C | |
| B. | A、C两点气体的颜色:A深,C浅 | |
| C. | 由状态B到状态A,可以用加热的方法 | |
| D. | A、C两点气体的平均相对分子质量:A>C |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com