
【题目】为探究Na2SO3溶液的性质,在白色点滴板的a、b、c、d四个凹槽中滴入Na2SO3溶液,再分别滴加下图所示的试剂。
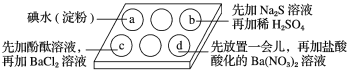
对实验现象的“解释或结论”错误的是
选项 | 实验现象 | 解释或结论 |
A | a中溶液褪色 | 还原性:SO32->I- |
B | b中加硫酸后产生淡黄色沉淀 | SO32-和S2-在酸性条件下发生反应 |
C | c中滴入酚酞溶液变红,再加BaCl2溶液后产生白色沉淀且红色褪去 | SO32-+H2O |
D | d中产生白色沉淀 | Na2SO3溶液已变质 |
A. AB. BC. CD. D
【答案】D
【解析】
A、Na2SO3溶液中亚硫酸钠具有还原性,和碘单质反应生成硫酸钠、碘化钠,亚硫酸钠做还原剂,碘化钠是还原产物,还原性:SO32->I-,故A正确;
B、Na2SO3中硫元素是+4价,硫化钠中硫元素是-2价,二者混合和硫酸溶液发生氧化还原反应,产物中硫元素呈0价,即生成淡黄色硫单质沉淀,故B正确;
C、Na2SO3溶液中亚硫酸根离子水解显碱性,该溶液会使酚酞变红,加入氯化钡会结合亚硫酸根离子形成亚硫酸钡沉淀,水解平衡逆向进行,氢氧根离子浓度减小,碱性逐渐消失,所以红色褪去,故C正确;
D、亚硫酸钠具有还原性,加入盐酸酸化的硝酸钡,即相当于加入了硝酸,亚硫酸根离子能被硝酸氧化为硫酸根,硫酸根离子可以和钡离子反应生成硫酸钡沉淀,该沉淀不溶于硝酸,所以实验证明的是亚硫酸根离子的还原性,是被硝酸氧化的缘故,故D错误。
故选D。


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】已知:将Cl2通入适量KOH溶液中,产物中可能含有KCl、KClO、KClO3,且![]() 的值与温度高低有关。当n(KOH)=a mol时,下列说法不正确的是
的值与温度高低有关。当n(KOH)=a mol时,下列说法不正确的是
A.参加反应的氯气的物质的量等于![]() a mol
a mol
B.改变温度,产物中KClO3的最大理论产量为![]() a mol
a mol
C.改变温度,反应中转移电子的物质的量n(e-)的范围为![]() a mol≤n(e-)≤
a mol≤n(e-)≤![]() a mol
a mol
D.若某温度下,反应后![]() =11,则溶液中
=11,则溶液中![]() =
=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2分别通入下列各溶液中,下列有关说法正确的是
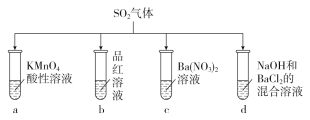
A. 试管a中实验可以证明SO2具有漂白性
B. 试管b中溶液褪色,说明SO2具有强氧化性
C. 试管c中能产生白色沉淀,说明SO2具有还原性
D. 试管d中能产生白色沉淀,加入稀硝酸后沉淀完全溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烃A分子内含有碳碳双键,并有如下转化关系:

请回答:
(1)E的分子式是_____________,C的结构简式是____________。
(2)反应①、②,分别属于的反应类型是①___________、②_____________
(3)写出反应B ![]() C的化学方程式__________________________________
C的化学方程式__________________________________
(4)写出两分子E酯化生成六元环酯的化学方程式:_______________________________________
(5)A有多种同分异构体,写出满足下列条件的一种同分异构体的结构简式:_________
a.分子中有苯环,且能使溴水褪色 b.苯环上有两个间位取代基
(6)写出E在一定条件下发生消去后的产物合成高分子的化学方程式__________________________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在新制饱和氯水中,若只改变某一条件,下列叙述正确的是
A. 再通入少量氯气,![]() 减小
减小
B. 通入少量SO2,溶液漂白性增强
C. 加入少量的碳酸氢钠粉末,pH增大,溶液漂白性增强
D. 光照过程中,有气泡冒出,溶液的导电性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含硫单质的水可治皮肤病,而硫难溶于水,微溶于酒精,易溶于![]() ,要增大硫在水中的分散程度,可将硫先放入溶剂X中,再将所得液体分散在水中,则X可以是
,要增大硫在水中的分散程度,可将硫先放入溶剂X中,再将所得液体分散在水中,则X可以是
A. ![]() B. 氯仿C.
B. 氯仿C. ![]() D. 酒精
D. 酒精
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜元素在化合物中其化合价可以呈现![]() 、
、![]() 价。
价。![]() 和
和![]() 是常见的
是常见的![]() 价铜的化合物,
价铜的化合物,![]() 是较为常见的
是较为常见的![]() 价铜的化合物。
价铜的化合物。
(1)铜元素位于周期表的_______区。
A、s B、p C、d D、ds E、f
(2)向![]() 溶液中滴加氨水,可以得到深蓝色的溶液,再加入乙醇后析出深蓝色晶体,写出深蓝色晶体的化学式__________________。比较
溶液中滴加氨水,可以得到深蓝色的溶液,再加入乙醇后析出深蓝色晶体,写出深蓝色晶体的化学式__________________。比较![]() 和
和![]() 中
中![]() 键角的大小:
键角的大小:![]() ___________
___________![]() 填“
填“![]() ”或“
”或“![]() ”
”![]() 。
。
(3)![]() 中阴离子的空间构型为_______,NO3-中的大π键应表示为______
中阴离子的空间构型为_______,NO3-中的大π键应表示为______
[信息:臭氧分子中,中心氧原子的未杂化的p轨道(含2个电子)与其它两个氧原子的p轨道(各含1个电子)肩并肩形成一个大π键,表示为![]() ,]
,]
![]() 的晶胞结构如图所示,C1原子位于立方体的顶点和面心,Cu原子位于Cl原子构成的四面体体心。
的晶胞结构如图所示,C1原子位于立方体的顶点和面心,Cu原子位于Cl原子构成的四面体体心。
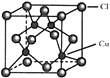
①每个Cl原子周围距Cl原子最近且等距离的Cu原子数目为________________。
②若以铜原子为顶点构成晶胞,面心原子为________(Cu、Cl)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)化合物BrFx与水按物质的量之比3 :5发生反应,其产物为溴酸(HBrO3)、氢氟酸、单质溴和氧气。
①BrFx中,x=__________。
②该反应的化学方程式为__________________________________________。
③此反应的氧化剂是______________,还原剂是______________。
(2)配平下列反应式,并用双线桥标出电子转移的方向和数目
____KMnO4 +____H2O2+____H2SO4 ─____K2SO4+____MnSO4+___ O2↑ + ____H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某硫酸镁和硫酸铝的混合溶液中,c(Mg2+ )=2 mol·L-1,c(SO42-)=6.5 mol·L-1,若将200 mL此混合液中的Mg2+和Al3+分离,至少应加入1.6 mol·L-1氢氧化钠溶液的体积是
A.0.5 L B.1.625 LC.1.8 LD.2 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com