
常温下,某溶液中由水电离的[H+]=1×10-13 mol·L-1,该溶液可能是( )
①三氧化硫水溶液 ②氯化铵水溶液 ③硝酸钠水溶液 ④氢氧化钠水溶液
A.①④ B.①② C.②③ D.③④
科目:高中化学 来源: 题型:
.已知HCN(aq)与NaOH(aq)反应生成1 mol正盐的ΔH=-12.1 kJ/mol;强酸、强碱的稀溶液反应的中和热ΔH=-57.3 kJ·mol-1。则HCN在水溶液中电离的ΔH等于
A.-69.4 kJ·mol-1 B.-45.2 kJ·mol-1
C.+69.4 kJ·mol-1 D.+45.2 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质的保存方法正确的是
①少量金属钠保存在冷水中②浓硝酸盛放在无色试剂瓶中
③少量金属钾保存在煤油中④氢氧化钠溶液盛放在带有橡胶塞的试剂瓶中
⑤氯水存放在带玻璃塞的无色细口瓶中⑥碳酸钠固体保存在带橡胶塞的细口瓶中
A.②③④ B.③④⑥ C.③④ D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
很多微粒具有六元环的结构。
Ⅰ.六氯环三磷腈分子中包含一个六元环,是橡胶生产中的重要中间体,其结构如图所示,其熔点为113℃,在减压下,50℃即可升华。在有机溶剂中,六氯环三磷腈可由五氯化磷与氯化铵反应制得,反应的方程式为3PCl5+3NH4Cl====P3N3Cl6+12HCl。
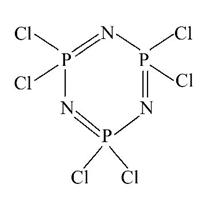
(1)比较磷元素和氯元素的第一电离能:P______Cl(填“>”或“<”)。
(2)在上述反应中断裂的化学键有________(填序号)。
A.离子键 B.配位键 C.极性键 D.非极性键
(3)P3N3Cl6的晶体类型为___________。
Ⅱ.1,3-戊二酮通过两步变化,也可以形成六元环,增加了分子的稳定性,其变化如图所示:
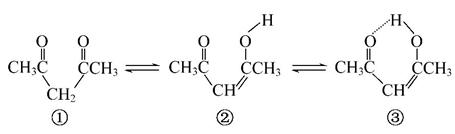
(4)由①转化为②时,π键数目________(填“增加”“减小”或“不变”)。
(5)由②转化为③时,③比②多增加了一种微粒间作用力,该作用力是__________。
Ⅲ.S和Ge可构成[Ge4S10]4-,锗和硫原子也连结成六边形结构,如图所示。
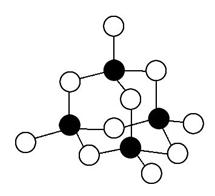
(6)锗原子的价电子排布式为_______。
(7)图中涂黑的微粒代表__________元素。
查看答案和解析>>
科目:高中化学 来源: 题型:
在常温下,pH=9的NaOH溶液和CH3COONa溶液中,假设由水电离产生的OH-浓度分别为a和b,则a与b的关系为( )
A.a>b B.a=10-4b C.b=10-4a D.a=b
查看答案和解析>>
科目:高中化学 来源: 题型:
MOH和ROH两种一元碱的溶液分别加水稀释10n倍时,pH变化与n的关系如图所示。下列叙述中正确的是
( )
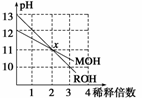
A.MOH和ROH都是强碱
B.稀释前,[ROH]=10[MOH]
C.常温下pH之和为14的醋酸和ROH溶液等体积混合,所得溶液呈碱性
D.在x点,[M+]=[R+]
查看答案和解析>>
科目:高中化学 来源: 题型:
物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看作化学平衡的一种。请根据所学化学知识回答下列问题:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中离子浓度由大到小的顺序为
________________________________________________________________________
________________________________________________________________________。
(2)B为0.1 mol·L-1的NaHCO3溶液,NaHCO3在该溶液中存在的平衡有(用离子方程式表
示)________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
(3)C为0.1 mol·L-1的(NH4)2Fe(SO4)2溶液,与同浓度的(NH4)2SO4溶液相比较____________(填溶质的化学式)溶液中NH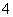 的浓度更大,其原因是
的浓度更大,其原因是
________________________________________________________________________
________________________________________________________________________。
(4)D为含有足量AgCl固体的饱和溶液,AgCl在溶液中存在如下平衡:AgCl(s)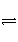
 Ag+(aq)+Cl-(aq)
Ag+(aq)+Cl-(aq)
在25℃时,AgCl的Ksp=1.8×10-10 mol2·L-2。现将足量AgCl分别放入下列液体中:①100 mL蒸馏水
②100 mL 0.3 mol·L-1AgNO3溶液 ③100 mL 0.1 mol·L-1 MgCl2溶液充分搅拌后冷却到相同温度,Ag+浓度由大到小的顺序为____________(填序号),此时溶液②中Cl-物质的量浓度为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
0.102 6 mol·L-1的盐酸滴定25.00 mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定
管中的液面如图所示,正确的读数为 ( )

A.22.30 mL B.22.35 mL
C.23.65 mL D.23.70 mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com