
分析 31.2gNaHSO3的物质的量为:$\frac{31.2g}{104g/mol}$=0.3mol,
(1)滴NaIO3就开始析出I2,必须将NaHSO3的溶液全部转化为Na2SO4,根据方程式:2NaIO3+6NaHSO3═2NaI+3Na2SO4+3H2SO4,计算NaIO3溶液的体积;
(2)当v为55mL时,则参与反应5NaI+NaIO3+3H2SO4═3I2+3Na2SO4+3H2SO4+3H2O的NaIO3的物质的量为:(55-50)ml×2mol/L=0.01mol,而由反应:
5NaI+NaIO3+3H2SO4═3I2+3Na2SO4+3H2SO4+3H2O,
1 3
0.01 n(I2)
n(I2)=0.03,由此解答.
解答 解:31.2gNaHSO3的物质的量为:$\frac{31.2g}{104g/mol}$=0.3mol,
(1)滴NaIO3就开始析出I2,必须将NaHSO3的溶液全部转化为Na2SO4,根据方程式:
2NaIO3 +6NaHSO3═2NaI+3Na2SO4+3H2SO4,
2 6
2mol/L×V(NaIO3)0.3mol
所以$\frac{2}{6}=\frac{2mol/L×V(NaI{O}_{3})}{0.3mol}$
解这得:V(NaIO3)=50mL,故答案为:50;
(2)当v为55mL时,则参与反应5NaI+NaIO3+3H2SO4═3I2+3Na2SO4+3H2SO4+3H2O的NaIO3的物质的量为:(55-50)ml×2mol/L=0.01mol,而由反应:
5NaI+NaIO3+3H2SO4═3I2+3Na2SO4+3H2SO4+3H2O,
1 3
0.01 n(I2)
n(I2)=0.03,所以生成0.03mol的I2,质量为0.03×254=7.62克,故答案为:7.62.
点评 本题是一道有关氧化还原反应的综合题,考查角度广,要求学生具有分析和解决问题的能力,难度较大.


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:选择题
| A. | 容器中SO2、O2、SO3共存 | |
| B. | SO2与SO3的浓度相等 | |
| C. | 容器中SO2、O2、SO3的物质的量之比为2:1:2 | |
| D. | ν正(SO2)=2ν逆(O2) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe(SCN)3溶液中加入固体KSCN后颜色变深 | |
| B. | 密闭容器中发生反应H2+I2=2HI,增大压强时,容器中颜色加深 | |
| C. | 将混合气中的氨气液化后不停的分离出来,有利于合成氨的反应 | |
| D. | 用过量空气煅烧硫铁矿可以提高硫铁矿的利用率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量CO2通入过量氨水中:NH3•H2O+CO2═NH4++HCO3- | |
| B. | 含等物质的量的NH4HSO3与NaOH溶液混合加热:HSO3-+OH-$\frac{\underline{\;△\;}}{\;}$SO32-+H2O | |
| C. | 溴化亚铁溶液中通入少量Cl2:Cl2+2Br-═2Cl-+Br2 | |
| D. | 含1molKOH的溶液与含2molBa(HCO3)2的溶液混合:Ba2++2HCO3-+2OH-═BaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
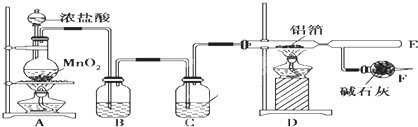
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究性学习小组参照课文中的实验装置图做高温下铁与水蒸气反应的实验装置如图.在玻璃管中放入铁粉和石棉绒的混合物,加热,并通入水蒸气.用试管收集产生的干燥气体,并靠近火焰点火,观察现象.请回答下列问题:
某研究性学习小组参照课文中的实验装置图做高温下铁与水蒸气反应的实验装置如图.在玻璃管中放入铁粉和石棉绒的混合物,加热,并通入水蒸气.用试管收集产生的干燥气体,并靠近火焰点火,观察现象.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用 10 m 量筒量取 5.2 mL盐酸 | |
| B. | 用 100 mL量筒量取 5.2 mL盐酸 | |
| C. | 用托盘天平称取25.02g NaCl | |
| D. | 用100 mL容量瓶配制50 mL 0.1 mol/L的盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com