
现有A、B、C三种化合物,各取40g相混合,完全反应后,得18g B,49g C,还有D生成.已知D的式量为106.现将22gA和11gB反应,能生成D()
| A. | 1mol | B. | 0.5mol | C. | 0.275mol | D. | 0.25mol |
| 化学方程式的有关计算. | |
| 专题: | 计算题. |
| 分析: | 40gA完全反应,参加反应的B的质量为40g﹣18g=22g,生成的C的质量为49g﹣40g=9g,根据质量守恒定律计算生成的D的质量,根据质量定比定律,计算22gA和11gB反应,哪种物质有剩余,根据不足量的物质利用质量定比关系计算生成D的质量,再根据n= |
| 解答: | 解:40gA完全反应,参加反应的B的质量为40g﹣18g=22g,生成的C的质量为49g﹣40g=9g,根据质量守恒定律可知,生成的D的质量为40g+22g﹣9g=53g, 若11gB完全反应需要A的质量为40g× 故生成D的物质的量为 故选D. |
| 点评: | 本题考查化学方程式的计算及质量守恒定律,题目难度不大,根据质量守恒计算反应中各组分的质量关系是解题的关键,注意过量计算. |


科目:高中化学 来源: 题型:
影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究。
实验一:他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5 mol·L-1、2 mol·L-1、18.4 mol·L-1)设计实验方案来研究影响反应速率的因素。
甲同学的实验报告如下表:
| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2 mol·L-1的硫酸于试管中 ②____________ | 反应速率Mg>Fe,Cu不反应 | 金属的性质越活泼,反应速率越快 |
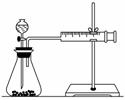
(1)甲同学表中实验步骤②为____________________________。
(2)甲同学的实验目的是____________________________________________________
________________________________________________________________________;
要得出正确的实验结论,还需控制的实验条件是____________。乙同学为了更精确地研究浓度对反应速率的影响,利用如图所示装置进行定量实验。
(3)乙同学在实验中应该测定的数据是
________________________________________________________________________
________________________________________________________________________。
(4)乙同学完成该实验应选用的实验药品是____________
________________________________________________________________________,
该实验中不选用某浓度的硫酸,理由是______________________________________
________________________________________________________________________。
实验二:已知 2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(5)针对上述实验现象,丙同学认为KMnO4与H2C2O4反应放热,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你猜想还可能是______________的影响。
(6)若用实验证明你的猜想,除高锰酸钾酸性溶液、草酸溶液外,还需要选择的试剂最合理的是________(填字母)。
A.硫酸钾 B.硫酸锰
C.二氯化锰 D.水
查看答案和解析>>
科目:高中化学 来源: 题型:
假设图中原电池产生的电压、电流强度均能满足电解、电镀要求,即为理想化。①~⑧为各装置中的电极编号。下列说法错误的是( )
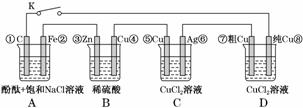
A.当K闭合时,A装置发生吸氧腐蚀,在电路中作电源
B.当K断开时,B装置锌片溶解,有氢气产生
C.当K闭合后,整个电路中电子的流动方向为①→⑧;⑦→⑥;⑤→④;③→②
D.当K闭合后,A、B装置中pH变大,C、D装置中pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
化学平衡常数(K)、弱酸的电离平衡常数(Ka)、难溶物的溶度积常数(Ksp)是判断物质性质或变化的重要的平衡常数。下列关于这些常数的说法中,正确的是( )
A.平衡常数的大小与温度、浓度、压强、催化剂等有关
B.当温度升高时,弱酸的电离平衡常数Ka变小
C.Ksp(AgCl)>Ksp(AgI) ,由此可以判断AgCl(s) + I-(aq)===AgI(s)+ Cl-(aq)能够发生
D.Ka(HCN)<Ka(CH3COOH) ,说明物质的量浓度相同时,氢氰酸的酸性比醋酸强
查看答案和解析>>
科目:高中化学 来源: 题型:
运用化学反应原理研究卤族元素的性质具有重要意义。
(1)下列关于氯水的叙述正确的是________(填写字母)。
a.氯水中存在两种电离平衡
b.向氯水中通入SO2,其漂白性增强
c.向氯水中通入氯气,c(H+)/c(ClO-)减小
d.加水稀释氯水,溶液中的所有离子浓度均减小
e.加水稀释氯水,水的电离平衡向正反应方向移动
f.向氯水中加入少量固体NaOH,可能有c(Na+)=c(Cl-)+c(ClO-)
(2)常温下,已知25 ℃时有关弱酸的电离平衡常数:
| 弱酸化学式 | HClO | H2CO3 |
| 电离平衡常数 | 4.7×10-8 | K1=4.3×10-7 K2=5.6×10-11 |
写出84消毒液露置在空气中发生反应的离子方程式
________________________________________________________________________
________________________________________________________________________。
(3)电解饱和食盐水可得到溶质为M的碱溶液,常温下将浓度为c1的M溶液与0.1 mol·L-1的一元酸HA等体积混合,所得溶液pH=7,则c1________0.1 mol·L-1(填“≥”、“=”或 “≤”),溶液中离子浓度的大小关系为______________________________。若将上述“0.1 mol·L-1的一元酸HA”改为“pH=1的一元酸HA”,所得溶液pH仍为7,则c1________0.1 mol·L-1。
(4)牙釉质对牙齿起着保护作用,其主要成分为羟基磷灰石,研究证实氟磷灰石比它更能抵抗酸的侵蚀,故含氟牙膏已使全世界千百万人较少龋齿,请写出羟基磷灰石的溶度积常数表达式Ksp=____________,氟离子与之反应转化的离子方程式为
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
将100g溶质质量分数为16%的盐酸与100g溶质质量分数为16%的NaOH溶液混合后,滴入几滴紫色石蕊试液,则最终溶液颜色是()
| A. | 蓝色 | B. | 紫色 | C. | 红色 | D. | 无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
为了证明长期暴露在空气中的氢氧化钠浓溶液已部分变质,某同学先取2mL试样于试管中,而后进行如下实验,其中不能达到目的是()
| A. | 加入少量盐酸,观察现象 | B. | 加入澄清石灰水,观察现象 | |
| C. | 加入氯化钡溶液,观察现象 | D. | 通适量CO2气体,观察现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,RO3n﹣和氟气可发生如下反应:RO3n﹣+F2+2OH﹣═RO4﹣+2F﹣+H2O从而可知在RO3n﹣中,元素R的化合价是()
| A. | +4 | B. | +5 | C. | +6 | D. | +7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
我国古代青铜器工 艺精湛,有很高的艺术价值和历史价值,但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义。
艺精湛,有很高的艺术价值和历史价值,但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义。
(1)原子序数为29的铜元素位于元素周期表中第 周期。
(2)某青铜器中Sn、Pb的质量分别为119g、20.7g,则该青铜器中Sn和Pb原子的数目之比为 。
(3)研究发现,腐蚀严重的青铜器表面大都存在CuCl。关于CuCl在青铜器腐蚀过程中的催化作用,下列叙述正确的是 。
A.降低了反应的活化能 B.增大了反应的速率
C.降低了反应的焓变 D.增大了反应的平衡常数
(4)采用“局部封闭法”可以防止青铜器进一步被腐蚀。如将糊状 Ag2O涂在被腐蚀部位
Ag2O涂在被腐蚀部位 ,Ag2O与有害组分CuCl发生复分解反应,该化学方程式为 。
,Ag2O与有害组分CuCl发生复分解反应,该化学方程式为 。
(5)题11图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图。
①腐蚀过程中,负极是 (填图中字母“a”或“b”或“c”);
②环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈u2(OH)3Cl,其离子方程式为 ;
③若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为 L(标准状况)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com