
【题目】氮化铝(AlN)陶瓷是一种新型无机非金属材料,利用它较高的体积电阻率、绝缘强度大、导热性能好,可用作大功率半导体器件的绝缘基片、大规模和超大规模集成电路的散热基片和封装基片。工业上可用氮气和铝在高温下直接化合法来制备氮化铝粉体(AlN粉体在潮湿的空气中易发生水解反应)。已知:实验室可用饱和亚硝酸钠(NaNO2)溶液和氯化铵溶液共热制取氮气。现提供以下装置来模拟工业制取AlN粉体。
(1)写出实验室制取氮气的化学方程式:___________________________。
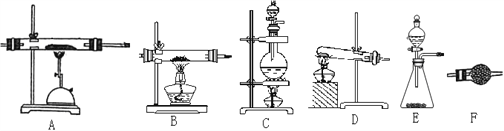
(2)请从下图中选择合适的装置按顺序组装一套用氮气和铝粉制AlN的装置(装置可以根据需要重复使用):________________________________。
(3)实验开始后应先给_______处装置加热一段时间再给另一处装置加热,这样操作的原因是:_______________。
(4)已知:氮化铝(AlN)既能溶于强酸,又能溶于强碱,试写出AlN与HCl溶液反应的化学方程为________________。
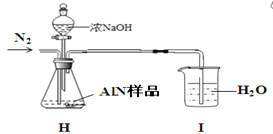
(5)AlN制备过程中存在一些副反应致生成的AlN不纯。 研究小组的同学取2.0500 g AlN样品与浓NaOH溶液充分反应,通过测定产生氨气的量来测定AlN的纯度(假设杂质与碱反应不生成NH3,忽略NH3在强碱性溶液中的溶解)。实验装置如下:请帮该同学纠正装置中一处明显错误:___________________。当H中反应完全后持续缓慢通入氮气将生成的氨全部吹入I中被水吸收。然后将I中氨水_________________________________________________________________________(请补充完这步操作,需根据后面数据计算作答),用_______取25.00mL氨水于锥形瓶中并加入几滴_______作指示剂,用0.1000mol/L的盐酸滴定至终点,消耗盐酸体积为22.50mL,经计算得AlN的纯度为90.00 %。
【答案】 NaNO2+NH4Cl=N2↑+NaCl+2H2O CFAF C 通氮气排尽装置内空气,防止氧气干扰实验 AlN+4HCl=AlCl3+NH4Cl 将I中导管改为连接一个倒扣漏斗吸收氨气 转移到500mL容量瓶中定容配成500mL溶液 碱式滴定管 甲基橙
【解析】 (1)由题意知,实验室用饱和亚硝酸钠(NaNO2)溶液和氯化铵溶液共热制取氮气,该反应的化学方程式为NaNO2+NH4Cl=N2↑+NaCl+2H2O。
(2)可以选择C作为氮气的发生装置,选择F作为氮气的干燥装置,选择A作为氮化铝的制备装置,最后再加一个F,防止空气中的水蒸气进入A装置,引起氮化铝水解。所以,可以按CFAF顺序组装一套用氮气和铝粉制AlN的装置。
(3)实验开始后应先给C处装置加热一段时间再给另一处装置加热,这样操作的原因是:通氮气排尽装置内空气,防止氧气干扰实验。
(4)由于氮化铝(AlN)既能溶于强酸,又能溶于强碱,所以AlN与HCl溶液反应可以生成两种盐,其化学方程为AlN+4HCl=AlCl3+NH4Cl。
(5) 该实验装置中的尾气处理装置设计不正确,容易引起倒吸,应将I中导管改为连接一个漏斗倒扣于烧杯水面吸收氨气。当H中反应完全后持续缓慢通入氮气将生成的氨全部吹入I中被水吸收。然后将I中氨水转移到500mL容量瓶中定容配成500mL溶液,用碱式滴定管取25.00mL氨水于锥形瓶中并加入几滴甲基橙作指示剂,用0.1000mol/L的盐酸滴定至终点,消耗盐酸体积为22.50mL,经计算得AlN的纯度为90.00 %。


科目:高中化学 来源: 题型:
【题目】咖啡酸具有较广泛的抑菌作用,结构简式为![]() 。下列有关说法中正确的是
。下列有关说法中正确的是
A. 该物质可以发生水解反应
B. 可以用酸性高锰酸钾溶液检验碳碳双键
C. 1 mol咖啡酸与足量钠、碳酸氢钠溶液反应,在相同条件下生成气体的体积比为1∶2
D. 1 mol咖啡酸可与4 mol Br2发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2016·新课标全国卷Ⅰ)元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4(绿色)、Cr2O72(橙红色)、CrO42(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(1)Cr3+与Al3+的化学性质相似。在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是_________。
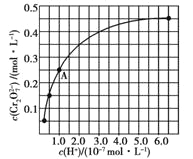
(2)CrO42和Cr2O72在溶液中可相互转化。室温下,初始浓度为1.0 mol![]() L1的Na2CrO4溶液中c(Cr2O72)随c(H+)的变化如图所示。
L1的Na2CrO4溶液中c(Cr2O72)随c(H+)的变化如图所示。
①用离子方程式表示Na2CrO4溶液中的转化反应____________。
②由图可知,溶液酸性增大,CrO42的平衡转化率__________(填“增大”“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为__________。
③升高温度,溶液中CrO42的平衡转化率减小,则该反应的ΔH__0(填“大于”“小于”或“等于”)。
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl,利用Ag+与CrO42生成砖红色沉淀,指示到达滴定终点。当溶液中Cl恰好沉淀完全(浓度等于1.0×105 mol·L1)时,溶液中c(Ag+)为_______ mol![]() L1,此时溶液中c(CrO42)等于__________ mol
L1,此时溶液中c(CrO42)等于__________ mol![]() L1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×1012和2.0×1010)。
L1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×1012和2.0×1010)。
(4)+6价铬的化合物毒性较大,常用NaHSO3将废液中的Cr2O72还原成Cr3+,该反应的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝热反应的实验装置如图。下列有关铝热反应的说法中,不正确的是
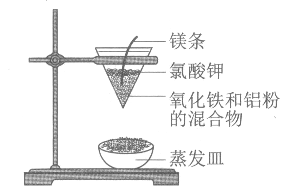
A. 铝热反应是放热反应
B. 铝热反应可用于冶炼某些高熔点金属
C. 实验中镁条的主要作用是还原氧化铁
D. 实验现象为火星四溅,漏斗下方有红热熔融物流出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作中,能使水的电离平衡向右移动且使液体呈酸性的是
A. 向水中加入NaHSO4 B. 向水中加入CuSO4
C. 向水中加入Na2CO3 D. 将水加热到100℃,使pH=6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中常伴随着能量变化。将Al条打磨后,插入6 mol/L盐酸中。
(1)Al与盐酸反应的离子方程式是________。
(2)该反应的能量变化可用下图中的________表示(填序号)。

(3)H2的产生速率随时间的变化如图所示。

t1~t2速率变化的主要原因是________。
t2~t3速率变化的主要原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在下列溶液中可能大量共存的离子组是
A. pH=0的溶液:Fe2+、Mg2+、NO3-、SO42-
B. 由水电离出的c(H+)=1×10-13 mol/L的溶液:Al3+、K+、SO42-、Cl-
C. c (OH-)/c(H+)=1012的溶液中:Na+、SO42-、NO3-、HCO3-
D. 滴加KSCN变红色的溶液:Na+、K+、Al3+、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E 都为短周期元素,A 原子失去一个电子后成为一个质子;C 的-1 价阴离子与氖原子具有相同的电子层结构;D在C 的下一周期,D可与同周期的B形成 BD2型离子化含物;E 和 C为同一周期元素,其最高价氧化物对应的水化物为一种强酸。请根据以上信息回答下列问题。
(1)B元素在元素周期表中的位置是____________。
(2)A与 E 形成的最简单化合物的电子式为____________。
(3)C的氢化物与 D的氢化物的沸点相比较: ____________(用化学式表示,且用>符号连接)。 解释原因______________。
(4)E 的氢化物与 E 的最高价氧化物对应水化物反应的生成物中含有的的化学键有____________。
(5)E 的最高价氧化物对应的水化物的稀溶液与过量铁粉发生反应的离子方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列配制的溶液浓度偏高的是( )
A.配制硫酸用量筒量取硫酸时俯视刻度线
B.配制盐酸定容时,仰视容量瓶刻度线
C.NaOH溶解后未经冷却即注入容量瓶至刻度线
D.称量4gNaOH配制0.1mol/L NaOH溶液1000mL时,砝码错放左盘
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com