
A.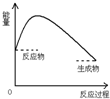 | B.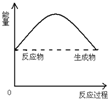 | C. | D.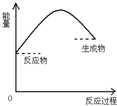 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.离子化合物不含共价键 |
| B.共价化合物可能含有离子键 |
| C.离子化合物中只含离子键 |
| D.共价化合物不含离子键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.若反应X+Y=M+N是放热反应,该反应一定不用加热 |
| B.需要加热才能发生的反应一定是吸热反应 |
| C.原电池正极和负极的材料必须是两种金属 |
| D.铜锌原电池工作时,若有13g锌被溶解,外电路中就有0.4mol电子通过 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CaO与H2O反应是吸热反应 |
| B.H2SO4与NaOH反应是放热反应 |
| C.H2燃烧是放热反应 |
| D.CaCO3受热分解是吸热反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.碳酸钙分解 |
| B.酸碱中和 |
| C.焦碳在高温下与水蒸气反应 |
| D.Ba(OH)2?8H2O与NH4Cl(固体)的反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 Cl2(g)+CO(g) △H=+108kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下同所示(第10min到14min的COCl2浓度变化曲线未示出):
Cl2(g)+CO(g) △H=+108kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下同所示(第10min到14min的COCl2浓度变化曲线未示出):
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com