
| A、常温下,将甲酸钠和适量盐酸混合,若所得的溶液恰好呈中性,则粒子间存在大小关系:c(Na+)>c(HCOO-)>c(HCOOH)>c(H+)=c(OH-) |
| B、将amol/L的Na2RO3溶液与bmol/L的NaHRO3溶液等体积混合,若离子间存在大小关系:c(Na+)>c(HRO3-)>c(RO32-)>c(OH-)>c(H+),则有:a<b |
| C、若KHA溶液呈酸性,则离子间一定存在大小关系:c(Na+)>c(HA-)>c(A2-)>c(H+)>c(OH-) |
| D、向硝酸银溶液中逐滴滴加物质的量浓度相等的氯化钾和铬酸钾的混合溶液,若先产生白色的氯化银沉淀,则有:Ksp(AgCl)<Ksp(Ag2CrO4) |


科目:高中化学 来源: 题型:
 已知2NO2(g)?N2O4(g)△H=-52.7kJ?mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
已知2NO2(g)?N2O4(g)△H=-52.7kJ?mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:查看答案和解析>>
科目:高中化学 来源: 题型:
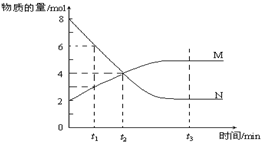
| A、该反应的化学方程式为:N?2M |
| B、t1时,正反应速率大于逆反应速率 |
| C、t2时,正逆反应速率相等,达到平衡 |
| D、t3时,M、N的浓度不再发生变化,反应停止 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、丁达尔效应是区分溶液和胶体的一种常用物理方法 |
| B、氯化钠溶液蒸发结晶时,必须将蒸发皿中的液体蒸干才能停止加热 |
| C、实验室可用KOH稀溶液除去NaCl溶液中混有的少量MgCl2杂质 |
| D、测定某溶液的pH,常用干燥洁净的玻璃棒蘸取该溶液滴在润湿的pH试纸上 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫离子的核外电子排布式:1s22s22p63s23p6 |
| B、N2的结构式::N≡N: |
C、NaCl的电子式: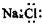 |
D、CO2的分子模型示意图: |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、①③④ |
| C、②④⑤ | D、①④⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com