
| A、浓硝酸可保存在带橡皮塞的棕色细口瓶中 |
| B、用pH试纸测定溶液pH时,pH试纸应事先润湿 |
| C、配制一定物质的量浓度的溶液时,选用的容量瓶规格由需配制的溶液体积决定 |
| D、中和滴定时,为了使滴定终点溶液颜色变化明显,可多滴几滴指示剂 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 电极反应式 | 出现环境 | |
| A | O2+2H2O+4e-=4OH- | 碱性环境下氢氧燃料电池的负极反应 |
| B | 4OH--4e-=O2↑+2H2O | 弱酸性环境下钢铁的吸氧腐蚀的正极 |
| C | 2H++2e-=H2↑ | 用Cu作电极电解NaOH溶液的阴极反应 |
| D | H2-2e-=2H+ | 用惰性电极电解H2SO4的阴极反应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
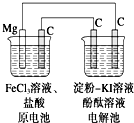 某研究性学习小组的课题为“MgC原电池电解淀粉KI溶液的研究”,其研究装置如图所示.下列有关说法不正确的是( )
某研究性学习小组的课题为“MgC原电池电解淀粉KI溶液的研究”,其研究装置如图所示.下列有关说法不正确的是( )| A、镁为负极,发生还原反应 |
| B、原电池中碳极反应式为Fe3++e-═Fe2+ |
| C、电解池中阳极处变蓝 |
| D、电解池中阴极处变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,Al与浓硫酸接触无明显现象,是由于Al与浓硫酸不反应 |
| B、SO2水溶液和氯水均具有漂白性,两者混合漂白性将增强 |
| C、已知相同温度下Ksp(BaSO4)<Ksp(BaCO3),故BaSO4无法转化为BaCO3 |
| D、CO2气体通入Na2SiO3溶液中产生白色沉淀,可说明碳元素的非金属性比硅元素强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||||||||||
| B、11.7g食盐晶体中的分子数为0.2×6.02×10-23 | ||||||||||
| C、等量的白磷蒸气和白磷固体分别完全燃烧,后者放出热量多 | ||||||||||
| D、根据分散系的稳定性大小将混合物分为胶体、溶液和浊液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
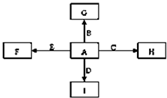 图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的
图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的| 高温 |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
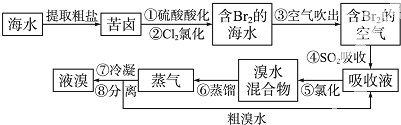
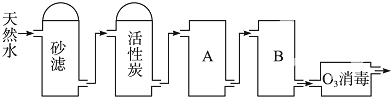
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com