
| Fe3+ | Fe2+ | Cu2+ | |
| 氢氧化物开始沉淀时的pH | 1.9 | 7 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9 | 6.7 |
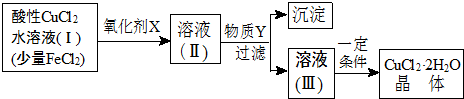
分析 氯化亚铁和氯化铜的混合液中,加入氧化剂可以将亚铁离子氧化为铁离子,调节pH可以将铁离子沉淀,得到氯化铜的水溶液,然后再酸性环境下蒸发浓缩、冷却结晶,过滤、洗涤、干燥即可得到氯化铜晶体,
(1)将Fe2+氧化为Fe3+;
(2)加入氧化剂,将Fe2+氧化为Fe3+,易除去,除杂时,不能引入新的杂质;过氧化氢具有氧化性,酸性溶液中氧化亚铁离子为铁离子;
(3)调节pH4~4.7,使Fe3+全部沉淀,同时不引进新杂质,调节溶液的pH的目的是使铁离子沉淀同时铜离子不能沉淀,据此判断;
(4)CuCl2属于强酸弱碱盐,加热蒸发时促进其水解(HCl易挥发),得不到CuCl2•2H2O;
(5)难溶电解质的溶解平衡及沉淀转化是溶解度大的物质向溶解度小的物质转化;
解答 解:(1)Fe2+沉淀为氢氧化物时所需pH与Cu2+的沉淀的pH相同,也就是说,Fe2+沉淀的同时,Cu2+也会沉淀,无法将两者分离开,根据题干提供信息可知Fe3+沉淀所需的pH较小,所以应先将Fe2+氧化为Fe3+后再将其除去,
故答案为:将Fe2+氧化为Fe3+,便于生成沉淀而与Cu2+分离;
(2)根据框图,加入氧化剂X可把Fe2+氧化为Fe3+,而没有增加新杂质,所以X为H2O2,在酸性条件下,氧化剂过氧化氢与Fe2+反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2 H2O,
故答案为:C; 2Fe2++H2O2+2H+=2Fe3++2 H2O;
(3)结合题示,调节pH为3.2~4.7,使Fe3+全部沉淀,同样不引进新杂质,所以Y最好为CuO或Cu(OH)2或CuCO3,
故答案为:CuO或Cu(OH)2或CuCO3或Cu2(OH)2CO3;调节溶液的pH至3.2~4.7;
(5)CuCl2属于强酸弱碱盐,加热蒸发时促进其水解(HCl易挥发),CuCl2+2H2O?Cu(OH)2+2HCl,温度升高,HCl挥发,水解平衡正向移动,得到Cu(OH)2固体,而无法得到晶体,在HCl气流中加热浓缩才能得到CuCl2•2H2O晶体,HCl气流起的作用是防止加热过程中CuCl2发生水解生成Cu (OH)2,
故答案为:防止加热过程中CuCl2发生水解生成Cu (OH)2;
(5)由ZnS转变为CuS,发生沉淀的转化,可表示为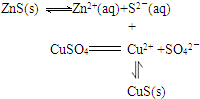 或ZnS(s)+Cu2+(aq)?CuS(s)+Zn2+(aq),
或ZnS(s)+Cu2+(aq)?CuS(s)+Zn2+(aq),
故答案为:Cu2+(aq)+ZnS(s)═Zn2+(aq)+CuS(s);
点评 本题考查除去氯化铜中氯化亚铁并得到氯化铜晶体的方法、溶度积常数的分析判断、氧化还原反应、除杂方法等,题目难度不大,注意除杂不能引入新的杂质.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 滴加的溶液 | 氯水 | 氨水 |
| 沉淀的化学式 | BaSO4 | BaSO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 名称 | 相对分子质量 | 性状 | 熔点/℃ | 溶解度 | |
| 水 | 乙醇 | ||||
| 甲苯 | 92 | 无色液体易烯易挥发 | -95 | 不溶 | 易溶 |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 122.4(100℃升华) | 25℃0.35g 80℃2.7g | 易溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
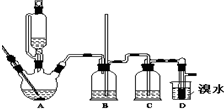 实验室制备1,2二溴乙烷的反应原理如下:
实验室制备1,2二溴乙烷的反应原理如下:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
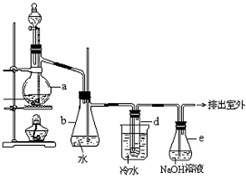 醇与氢卤酸反应是制备卤代烃的重要方法.实验室制备溴乙烷的装置如下图所示,试管d中装有少量蒸馏水.已知溴乙烷的沸点为38.4oC,密度为1.43g•ml-1;
醇与氢卤酸反应是制备卤代烃的重要方法.实验室制备溴乙烷的装置如下图所示,试管d中装有少量蒸馏水.已知溴乙烷的沸点为38.4oC,密度为1.43g•ml-1;查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
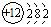 ,O2-结构示意图:
,O2-结构示意图: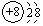 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量 | B. | 摩尔质量 | C. | 质量分数 | D. | 物质的量浓度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com