
【题目】某研究性学习小组设计了一组实验来探究元素周期律。
甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素C和Si的非金属性强弱比较的实验研究;
乙同学设计了如图2装置来验证卤族元素性质的递变规律,图2中A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红纸。
已知常温下浓盐酸与高锰酸钾能反应生成氯气。
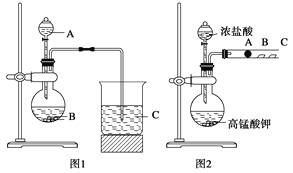
(1)从以下所给物质中选出甲同学设计的实验所用到物质:图1中试剂A、B为(填序号)____;
①稀硫酸溶液; ②浓盐酸; ③碳酸钠粉末;④Na2SO3溶液
写出图1烧瓶中发生反应的离子方程式为__________________________________________;
(2)甲同学所做实验图1烧杯中现象为____________________________________;
(3)乙同学所做实验图2中B处的现象为__________________________________;
(4)写出图2中A处发生反应的离子方程式为__________________________________________。
【答案】 ①③ CO32-+2H+=== 2CO2↑+H2O 溶液出现白色沉淀 试纸变蓝 2Br-+Cl2===2Cl-+Br2
【解析】(1)根据甲设计的实验装置图可知,其实验的原理是利用较强酸制较弱酸。图1中试剂A、B为①稀硫酸溶液,③碳酸钠粉末;有关反应的离子方程式:![]() 。
。
(2)因生成硅酸,不溶于水,实验图1烧杯中现象是溶液出现白色沉淀 。
(3)要验证卤族元素性质的递变规律,则可以利用活泼的非金属单质置换较不活泼的非金属单质来实现。酸性高锰酸钾溶液能把盐酸氧化生成氯气,所以B处反应的离子方程式是2I-+Cl2===2Cl-+I2。因生成I2,淀粉KI试纸变蓝。
(4)酸性高锰酸钾溶液能把盐酸氧化生成氯气,所以A处反应的离子方程式是:2Br-+Cl2===2Cl-+Br2。


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.胶体和溶液、浊液的本质区别是能否产生“丁达尔效应”
B.氢氧化铁胶体能吸附水中的悬浮颗粒并沉降,起到净水作用
C.当光束通过硫酸铜溶液时可看见一条光亮的通路
D.胶体的分散质粒子的直径大于10﹣7m
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是一种重要的含氧酸.实验室用浓硫酸与乙二酸(H2C2O4)晶体加热,可获得CO与CO2的混合气体,再将混合气体进一步通过(填一种试剂的名称)即可得纯净干燥的CO.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴乙烷的化学式________,它与氢氧化钠的水溶液共热发生反应的类型是_______________;与氢氧化钠的醇溶液共热发生的反应类型是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化过程中,ΔS<0的是
A. 氯化钠溶于水中 B. NH3(g)与HCl(g)反应生成NH4Cl(s)
C. 汽油的燃烧 D. 煅烧石灰石得到生石灰和二氧化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(双选)对于淀粉和纤维素的下列说法中,正确的是 ( )
A.组成相同,相对分子质量相同
B.都能水解,水解的最终产物相同,且产物都能发生银镜反应
C.化学性质相同
D.都属于混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机物在酸性催化条件下发生水解反应,生成两种不同的有机物,且这两种有机物的相对分子质量相等,该有机物是( )
A. 乙酸丙酯 B. 麦芽糖 C. 甲酸甲酯 D. 丙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的有( )
A.NH3、CO2溶于水可以导电,因此为电解质
B.焰色反应是某种金属元素灼烧时所具有的特殊颜色,是物理变化
C.强氧化剂与强还原剂之间一定能发生氧化还原反应
D. 阳离子只能得电子被还原,阴离子只能失电子被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ⅤA族的某些单质及其化合物常用于制作太阳能电池、半导体材料等。
(1)基态时砷原子核外的电子排布式为____________。
(2)硒、溴与砷同周期,三种元素的第一电离能从大到小顺序为____________(用元素符号表示)。
(3)气态SeO3分子的立体结构为____________,与SeO3互为等电子体的一种离子为____________(填化学式)。
(4)硼元素具有缺电子性,因而其化合物往往具有加和性。
①硼酸(H3BO3)是一元弱酸,写出硼酸在水溶液中的电离方程式____________。
②硼酸(H3BO3)是一种具有片层结构的白色晶体,层内的H3BO3分子间通过氢键相连(如图1)。含1 mol H3BO3的晶体中有____________mol氢键,____________molσ键。H3BO3中B的原子杂化类型为____________。
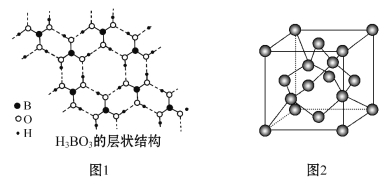
(5)硅的某种单质的晶胞如图2所示。若该硅晶体的密度为ρg·cm-3,阿伏加德罗常数值为NA,则晶体中最近的两个硅原子之间的距离为________cm(用代数式表示即可)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com