
| 8.96L |
| 22.4L/mol |


 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:
| A、①②③ | B、①②⑤ |
| C、①②③⑤ | D、①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
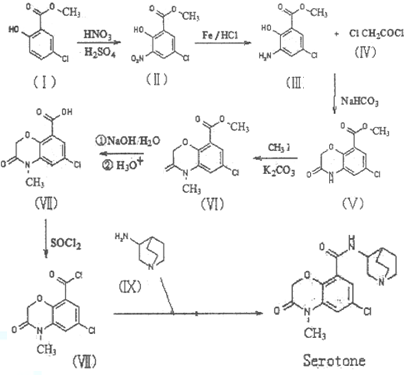
 .
. )的合成路线流程图(必要条件需注明,无机试剂任选).合成路线流程图示例如下:
)的合成路线流程图(必要条件需注明,无机试剂任选).合成路线流程图示例如下:
查看答案和解析>>
科目:高中化学 来源: 题型:
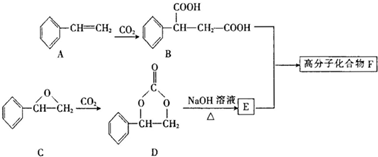
查看答案和解析>>
科目:高中化学 来源: 题型:


 为原料可以合成聚酯PTT,写出其化学方程式
为原料可以合成聚酯PTT,写出其化学方程式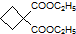 ,再转化为
,再转化为 .
. 的同分异构体不可能属于
的同分异构体不可能属于 ,必须先合成哪些物质?(用合成该物质的化学方程式回答)
,必须先合成哪些物质?(用合成该物质的化学方程式回答)查看答案和解析>>
科目:高中化学 来源: 题型:
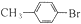 和CH3CH2CH2Br的方法如图1(已知:甲苯和液溴在有水存在时也能反应):
和CH3CH2CH2Br的方法如图1(已知:甲苯和液溴在有水存在时也能反应):
| 物质 | 甲苯 | 1-丙醇 | 1-溴丙烷 | 对溴甲苯 | 邻溴甲苯 |
| 沸点(℃) | 110.8 | 97.2 | 71 | 184.3 | 181.7 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
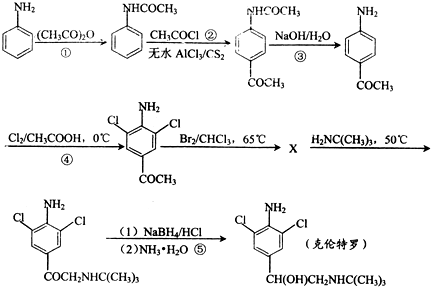
 ) 的同分异构体有多种,请写出符合以下条件的其中任意一种
) 的同分异构体有多种,请写出符合以下条件的其中任意一种查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com