
电镀污泥中含有Cr(OH)3、Al2O3、ZnO、CuO、NiO等物质,工业上通过“中温焙烧—钠氧化法”回收Na2Cr2O7等物质。
已知:水浸后溶液中存在Na2CrO4、NaAlO2、Na2ZnO2等物质
(1)水浸后的溶液呈____性(“酸”、“碱”、“中”)。
(2)完成氧化焙烧过程中生成Na2CrO4的化学方程式:
____Cr(OH)3+____Na2CO3+_____  = ____Na2CrO4+___CO2+_____
= ____Na2CrO4+___CO2+_____
(3)滤渣II的主要成分有Zn(OH)2、___________________________________。
(4)“系列操作”中为:继续加入H2SO4,________冷却结晶,过滤。继续加入H2SO4目的是________________________。
已知:①除去滤渣II后,溶液中存在如下反应:2CrO42ˉ+2H+ Cr2O72ˉ+H2O
Cr2O72ˉ+H2O
②Na2Cr2O7、Na2CrO4在不同温度下的溶解度如下表
| 温度 化学式 | 20℃ | 60℃ | 100℃ |
| Na2SO4 | 19.5 | 45.3 | 42.5 |
| Na2Cr2O7 | 183 | 269 | 415 |
| Na2CrO4 | 84 | 115 | 126 |
(16分)(1)碱性 (2分)
(2)4Cr(OH)3+4Na2CO3+3O2==4Na2CrO4+4CO2+6H2O(每种物质1分,配平2分,共4分)
(3)Al(OH)3(2分)
(4)蒸发浓缩(2分) 促进平衡2CrO42ˉ+2H+ Cr2O72ˉ+H2O向正反应方向移动,尽可能生成更多溶解度更大的Na2Cr2O7(3分)
Cr2O72ˉ+H2O向正反应方向移动,尽可能生成更多溶解度更大的Na2Cr2O7(3分)
(5)CrO42ˉ+8H++6eˉ=Cr+4H2O(3分)
解析试题分析:(1)碳酸钠、偏铝酸钠等是强碱弱酸盐,溶于水时能够水解,所得溶液呈碱性;(2)观察可知,铬元素由+3升为+6价,氢氧化铬作还原剂,则4Cr(OH)3+4Na2CO3+3O2==4Na2CrO4+4CO2+6H2O;(3)观察流程图,滤渣I的成分说明水浸过滤除去铜、镍,由于目标产物含铬,则加入硫酸调节pH的目的是除去锌、铝,因此推断滤渣II的主要成分是氢氧化锌、氢氧化铝;(4)根据混合物分离提纯的原理和方法推断,冷却结晶之前的操作为蒸发浓缩;由于硫酸具有酸性,铬酸根离子在溶液中存在如下平衡:2CrO42ˉ+2H+ Cr2O72ˉ+H2O,继续加入硫酸,使上述平衡右移,生成更多的重铬酸钠;根据溶解度表可知,重铬酸钠的溶解度随温度下降明显减小,因此蒸发浓缩、冷却结晶、过滤得到的滤渣III为重铬酸钠,滤液的主要成分硫酸钠和重铬酸钠;(5)铬元素由+6降为0价,发生还原反应,则该反应在阴极上发生,主要反应物和产物为CrO42ˉ→Cr;由于化合价降低总数等于得电子数,则CrO42ˉ+6eˉ→Cr;由于硫酸显酸性,应用氢离子使左右电荷守恒,则CrO42ˉ+6eˉ+8H+→Cr;根据原子个数守恒,阴极反应式为CrO42ˉ+6eˉ+8H+==Cr+4H2O。
Cr2O72ˉ+H2O,继续加入硫酸,使上述平衡右移,生成更多的重铬酸钠;根据溶解度表可知,重铬酸钠的溶解度随温度下降明显减小,因此蒸发浓缩、冷却结晶、过滤得到的滤渣III为重铬酸钠,滤液的主要成分硫酸钠和重铬酸钠;(5)铬元素由+6降为0价,发生还原反应,则该反应在阴极上发生,主要反应物和产物为CrO42ˉ→Cr;由于化合价降低总数等于得电子数,则CrO42ˉ+6eˉ→Cr;由于硫酸显酸性,应用氢离子使左右电荷守恒,则CrO42ˉ+6eˉ+8H+→Cr;根据原子个数守恒,阴极反应式为CrO42ˉ+6eˉ+8H+==Cr+4H2O。
考点:考查有关物质制备的化学工艺流程大题,涉及盐类的水解规律、氧化还原反应方程式的配平、除杂原理及滤渣成分推断、混合物分离提纯的方法、应用化学平衡移动原理解析加入硫酸的目的、阴极反应式的书写等。


 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:填空题
工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下: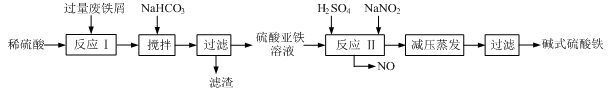
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4],生产铁红和补血剂乳酸亚铁。其生产步骤如下: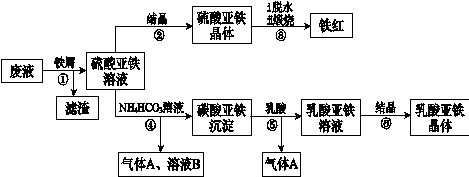
已知:TiOSO4可溶于水,在水中可以电离为TiO2+和SO42—。请回答:
(1)步骤①中分离硫酸亚铁溶液和滤渣的操作中所用的玻璃仪器是 。
步骤②得到硫酸亚铁晶体的操作为蒸发浓缩、 。
(1)步骤④的离子方程式是 。
(1)步骤⑥必须控制一定的真空度,原因是有利于蒸发水以及 。
(1)硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为 。
(1)用平衡移动的原理解释步骤⑤中加乳酸能得到乳酸亚铁的原因 。
(1)为测定步骤②中所得晶体中FeSO4·7H2O的质量分数,取晶体样品a g,溶于稀硫酸配成100.00 mL溶液,取出20.00 mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.1000 mol?L-1 KMnO4溶液20.00 mL,所得晶体中FeSO4·7H2O的质量分数为(用a表示) 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。工业上常采用NaClO氧化法生产,其生产工艺如下:
主要反应为:3NaClO+2Fe(NO3)3+10NaOH = 2Na2FeO4↓+3NaCl+6NaNO3+5H2O
Na2FeO4+2KOH=K2FeO4+2NaOH。
(1)写出反应①的离子方程式: 。
(2)从“混合物II”中分离出K2FeO4后,会有副产品,它们都是重要的化工产品,其中一种在工业上用作氯碱工业原料的物质是 。
(3)反应的温度、原料的浓度和配比对高铁酸钾的产率都有影响。图Ⅰ为不同的温度下,Fe(NO3)3不同质量浓度对K2FeO4生成率的影响;图Ⅱ为一定温度下,Fe(NO3)3质量浓度最佳时,NaClO浓度对K2FeO4生成率的影响。
图Ⅰ 图Ⅱ
根据上图分析:工业生产中最佳温度为 ℃,此时Fe(NO3)3与NaClO两种溶液最佳质量浓度之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下图是工业上生产碳酸锂的部分工艺流程,请根据流程图及已知信息回答问题。
②
③几种物质不同温度下的溶解度。
(1)从滤渣1中分离出Al2O3的部分流程如下图所示,括号表示加入的试剂,方框表示所得到的物质。写出图中①、②、③表示的各物质,步骤II中反应的离子方程式是 。
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3,写出生成滤渣2反应的离子方程式:
。
(3)向滤液2中加入饱和Na2CO,溶液,过滤后,用“热水洗涤”的原因是 。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下。
①将粗产品Li2CO3溶于盐酸作用解槽的阳极液,LiOH溶液作阴极液,两者用离子选择半透膜隔开,用惰性电极电解。阳极的电极反应式是 。
②电解后向产品LiOH溶液中加入过量NH4HCO,溶液生成Li2CO3反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
回收再利用锗产品加工废料,是生产GeO2的重要途径,其流程如下图。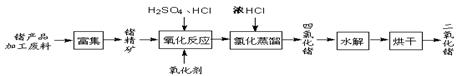
(1)Ge2+与氧化剂H2O2反应生成Ge4+,写出该反应的离子方程式 。
(2)蒸馏可获GeCl4,在此过程中加入浓盐酸的原因是 。
(3)GeCl4水解生成GeO2·nH2O,化学方程式为 。温度对GeCl4的水解率产生的影响如图1所示,其原因是该水解反应ΔH 0(“>”或“<”)。为控制最佳的反应温度,实验时可采取的措施为 水浴。
A.用冰水混合物 B.49℃水浴 C.用冰盐水
(4)已知Ge的单质和化合物性质与Al的相似,试用离子方程式表示在pH>8的溶液中GeO2逐渐溶解时发生的反应 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
充分利用能源、提高原子利用率、减少向环境排放废弃物等都是绿色化学的基本要求。①在有机实验中,用溴的四氯化碳溶液代替溴的水溶液;②用稀硝酸代替浓硝酸溶解、回收银镜试管中的银;③用水浴加热代替直接用酒精灯加热;④接触法制硫酸中采用“热交换器”,利用余热预热冷原料气和烧水;⑤工业合成氨中分离产物得到氢气和氮气再循环使用;⑥电解法冶炼钠和镁,选择电解氯化钠和氯化镁,不电解对应的金属氧化物。上述主要不是从绿色化学角度考虑的是( )
| A.①③ | B.②④ | C.⑤⑥ | D.③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列叙述中不属于土壤酸化原因的是( )。
| A.土壤胶体吸附的H+、Al3+被其他阳离子交换 |
| B.微生物、细菌在利用土壤中的有机物时,会产生二氧化碳和多种有机酸 |
| C.微生物、细菌在利用土壤中物质时,将土壤中的NH3转化为亚硝酸和硝酸,将硫化物转化为硫酸 |
| D.土壤有机物中的氮被微生物分解生成氨的氨化过程,会使土壤的pH升高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com