
| A. | 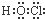 | B. | 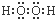 | C. | 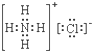 | D. | 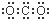 |
分析 A、HClO为共价化合物,分子中存在1个氧氢键和1个Cl-O键;
B、双氧水中两个氢原子分别与两个氧原子通过共用一对电子结合,两个氧原子之间通过共用1对电子结合;
C、氯化铵为离子化合物,由铵根离子和氯离子构成;
D、二氧化碳中存在两个碳氧双键,C、O原子最外层都达到最外层8个电子;
解答 解:A、HClO为共价化合物,分子中存在1个氧氢键和1个Cl-O键,次氯酸的电子式为: ,故A正确;
,故A正确;
B、双氧水为共价化合物,分子中存在两个氧氢键和一个O-O键,双氧水的电子式为: ,故B正确;
,故B正确;
C、氯化铵为离子化合物,由铵根离子和氯离子构成,故电子式为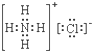 ,故C正确;
,故C正确;
D、二氧化碳中存在两对碳氧共用电子对,二氧化碳的电子式为: ,故D错误.
,故D错误.
故选D.
点评 本题考查了电子式的书写,题目难度不大,注意掌握电子式的概念及书写原则,明确离子化合物与共价化合物的电子式表示方法及区别.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L乙醇中含有的氧原子数为NA | |
| B. | 64g的S2和S8混合物中,含硫原子总数为2 NA | |
| C. | 1L 1mol/L氯化铁溶液中,含有NA个Fe3+ | |
| D. | 25℃时,pH=13的Ba(OH)2溶液中含有OH-数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 酚类-OH
酚类-OH 羧酸-COOH--
羧酸-COOH-- 醛类
醛类

 酯类
酯类
| A. | (1)(2)(3)(4)(5) | B. | (2)(4) | C. | (2)(3)(4) | D. | (2)(4)(5) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;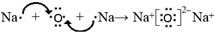 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题

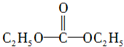 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
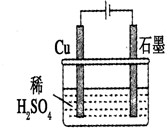
| A. | 石墨是电解池的负极,Cu是电解池的正极 | |
| B. | 电解过程中,铜电极上自身没什么变化 | |
| C. | 电解一定时间后,石墨电极上会有铜析出 | |
| D. | 整个电解过程中,溶液的pH不会变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
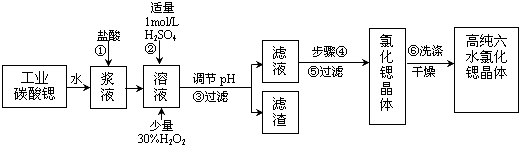
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com