
【题目】氰化物在冶金等行业应用广泛,含氰废水的处理显得尤为重要.含氰废水中的氰化物常以[Fe(CN)6]3﹣和CN﹣的形式存在,工业上有多种废水处理方法. 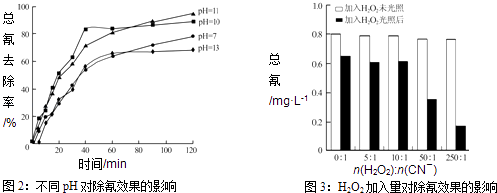
(1)电解处理法 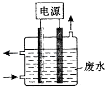
图1电源废水铁电极石墨电极
用图1所示装置处理含CN﹣废水时,控制溶液pH为9~10并加入NaCl,一定条件下电解,阳极产生的ClO﹣将CN﹣氧化为无害物质而除去.铁电极为(填“阴极”或“阳极”),阳极产生ClO﹣的电极反应为 .
(2)UV(紫外光线的简称)﹣H2O2氧化法. 实验过程:取一定量含氰废水,调节pH,加入一定物质的量的H2O2 , 置于UV工艺装置中,光照一定时间后取样分析.
【查阅资料】①在强碱性溶液中4[Fe(CN)6]3﹣+4OH﹣═4[Fe(CN)6]4﹣+O2↑+2H2O,[Fe(CN)6]4﹣更稳定;
②[Fe(CN)6]3﹣转化为CN﹣容易被H2O2除去;
③HCN是有毒的弱酸,易挥发.
Ⅰ.废水中的CN一经以下反应实现转化:CN一+H2O2+H2O═A+NH3↑,则A是(用符号表示).
Ⅱ.K3[Fe(CN)6]在中性溶液中有微弱水解,用方程式表示水解反应 .
Ⅲ.含氰废水在不同pH下的除氰效果如图2所示,pH选择的最佳范围应为(a.7﹣10;b.10﹣11;c.11﹣13),解释选择该pH范围的原因 .
Ⅳ.图3表示某pH时,加入不同量H2O2 , 处理30min后测定的样品含氰浓度.由图可知:n(H2O2):n(CN﹣)=250:1时,剩余总氰为0.16mgL﹣1 , 除氰率达80%,计算0﹣30min时间段反应速率v(CN﹣)=mgL﹣1min﹣1(结果保留两位有效数字).
【答案】
(1)阴极;2OH﹣+Cl﹣﹣2e﹣═ClO﹣+H2O
(2)HCO3﹣;[Fe(CN)6]3﹣+3H2O?Fe(OH)3+3HCN+3CN﹣;b;碱性适中,有利于[Fe(CN)6]3﹣转变为CN﹣而被氧化;碱性太强,溶液中4[Fe(CN)6]3﹣+4OH﹣═4[Fe(CN)6]4﹣+O2↑+2H2O生成[Fe(CN)6]4﹣后难以除去;碱性太弱[Fe(CN)6]3﹣难以水解释放出CN﹣(且水解产生少量HCN有毒);0.021
【解析】解:(1)废水中含CN﹣ , 控制溶液pH为9~10并加入NaCl,阳极产生的ClO﹣将CN﹣氧化,说明溶液中的氯离子在阳极失去电子发生氧化反应,电极反应为:2OH﹣+Cl﹣﹣2e﹣═ClO﹣+H2O,阴极是氢离子得电子产生氢气,铁是活性电极,在装置中只能作阴极,不参加反应,所以答案是:阴极;2OH﹣+Cl﹣﹣2e﹣═ClO﹣+H2O;(2)Ⅰ根据离子反应方程式CN﹣+H2O2+H2O═A+NH3↑可知,N化合价为﹣3价,反应前后不改变,只能是双氧水将C从+2介氧化到+4价,根据电荷守恒和原子守恒,A应是带一个负电荷的阴离子,且包含1个C,1个H,3个O,即HCO3﹣ ,
所以答案是:HCO3﹣;ⅡFe(OH)3是弱碱,HCN是弱酸,则K3[Fe(CN)6]在中性溶液中有Fe3+和CN﹣发生微弱水解,即[Fe(CN)6]3﹣+3H2OFe(OH)3+3HCN+3CN﹣ ,
所以答案是:[Fe(CN)6]3﹣+3H2OFe(OH)3+3HCN+3CN﹣;Ⅲ图2显示,PH在10﹣11时,除氰率超过80%,碱性适中,有利于[Fe(CN)6]3﹣转变为CN﹣而被氧化;碱性太强,溶液中4[Fe(CN)6]3﹣+4OH﹣═4[Fe(CN)6]4﹣+O2↑+2H2O生成[Fe(CN)6]4﹣后难以除去;碱性太弱[Fe(CN)6]3﹣难以水解释放出CN﹣(且水解产生少量HCN有毒),
所以答案是:b;碱性适中,有利于[Fe(CN)6]3﹣转变为CN﹣而被氧化;碱性太强,溶液中4[Fe(CN)6]3﹣+4OH﹣═4[Fe(CN)6]4﹣+O2↑+2H2O生成[Fe(CN)6]4﹣后难以除去;碱性太弱[Fe(CN)6]3﹣难以水解释放出CN﹣(且水解产生少量HCN有毒);Ⅳ剩余总氰为0.16mgL﹣1 , 除氰率达80%,则氰的总量为:0.16mgL﹣1÷(1﹣80%)=0.80mgL﹣1 ,
0﹣30分钟氰的改变量为:△c(CN﹣)=0.80mgL﹣1×80%=0.64mgL﹣1 , v(CN﹣)= ![]() =
= ![]() =0.021mgL﹣1min﹣1 ,
=0.021mgL﹣1min﹣1 ,
所以答案是:0.021.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列实验事实与图象对应正确的是( ) 
A.I表示向Na2SO3溶液中通入Cl2
B.II表示向纯CH3COOH中逐滴加水并不断振荡
C.III表示向KOH和Ca(OH)2混合液中通入CO2
D.Ⅳ表示向NaOH溶液中逐滴加入AlCl3溶液并不断振荡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下图所示装置制备干燥纯净的氯气,并进行氯气的性质实验,请回答下列问题:
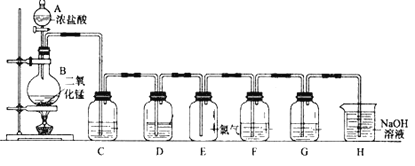
(1)仪器A的名称是____________。
(2)烧瓶中发生反应的化学方程式为(含条件)________________________。
(3)为在E装置中收集到干燥纯净的氯气,装置C中盛放的试剂为_____________(填写名称),作用是____________________________。
(4)F处盛有Na2S溶液,可用置换反应的原理证明氯的非金属性强于硫。反应的离子方程式为 _________________________________________。
(5)G中加入的是淀粉碘化钾溶液,发生反应的现象为_____________________________________。
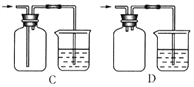
(6)H为尾气处理装置,写出该装置中的离子方程式_________________________。有人认为,用NaOH溶液吸收尾气,可能会引起倒吸。下列装置中,能起到防倒吸作用的是_______(填序号字母)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在向冰醋酸(无水醋酸)加水稀释的过程中,溶液的导电能力(I)随着加入水的体积V变化的曲线如图所示.
请回答:
(1)O点导电能力为0的理由是 .
(2)a、b、c三点处,溶液中c(H+)由小到大的顺序为 .
(3)a、b、c三点处,醋酸电离程度最大的是点.
(4)若使c点溶液中的c(CH3COO﹣)提高,下列措施中不可行的是
A.加热
B.加稀盐酸
C.加固体KOH
D.加水
E.加Zn粒
F.加固体CH3COONa
G.加MgO
I.加固体Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为2 L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如下图所示,对该反应的推断合理的是( )
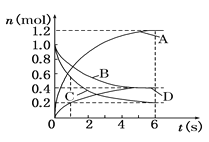
A. 该反应的化学方程式为3B+4D![]() 6A+2C
6A+2C
B. 反应进行到1 s时,v(A)=v(D)
C. 反应进行到6 s时,B的平均反应速率为0.05 mol/(L·s)
D. 反应进行到6 s时,各物质的反应速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 三聚氰酸(C3H3N3O3)的结构式为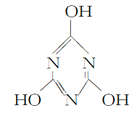 ,它属于共价化合物
,它属于共价化合物
B. 只含H、N、O三种元素的化合物,可能是离子化合物,也可能是共价化合物
C. NaHCO3、CH3COONa均含有离子键和共价键
D. 化合物MgO、H2O中化学键的类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】证明氨水是弱碱的事实是
A.氨水与硫酸发生中和反应B.氨水能使紫色石蕊试液变蓝
C.0.1 mol/L的NH4Cl溶液的pH值为5.1D.浓氨水易挥发
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2015·上海)研究电化学腐蚀及防护的装置如右图所示。下列有关说法错误的是( )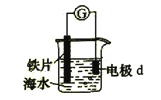
A.d为石墨,铁片腐蚀加快
B.d为石墨,石墨上电极反应为:O2 + 2H2O + 4e → 4OH–
C.d为锌块,铁片不易被腐蚀
D.d为锌块,铁片上电极反应为:2H+ + 2e → H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com