
| A. | 金属氧化物不可能是酸性氧化物 | |
| B. | 强电解质都是离子化合物,弱电解质都是共价化合物 | |
| C. | 某物质溶于水所得溶液能导电,该物质一定是电解质 | |
| D. | 醋酸溶液中存在两种共价化合物分子 |
分析 A.能和碱反应生成盐和水的氧化物是酸性氧化物,金属氧化物可能是酸性氧化物;
B.完全电离的电解质是强电解质,部分电离的电解质是弱电解质,电解质强弱与化合物类型无关,共价化合物可能是强电解质;
C.电解质是指在水溶液或熔化状态下能导电的化合物,导电是自身电离出自由移动的离子;
D.醋酸中存在弱电解质的电离平衡,存在醋酸分子和水分子.
解答 解:A.金属氧化物Mn2O7是酸性氧化物,故A错误;
B.完全电离的电解质是强电解质,部分电离的电解质是弱电解质,电解质强弱与化合物类型无关,共价化合物可能是强电解质,如硫酸、硝酸等都是强电解质,故B错误;
C.二氧化碳溶于水所得溶液能够导电,但属于非电解质,二氧化碳本身不能电离出离子,溶液导电是二氧化碳和水反应生成碳酸电离,CO2为非电解质,故C错误;
D.醋酸中存在弱电解质的电离平衡,醋酸和水都是弱电解质,所以醋酸溶液中存在醋酸分子和水分子,均为共价化合物,故D正确;
故选D.
点评 本题考查金属氧化物与酸性氧化物、强弱电解质与化合物类型关系、弱电解质的电离等知识,侧重考查基本概念,电解质强弱与电离程度有关,与化合物类型无关,为易错题,题目难度不大.


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 甲醛和足量银氨溶液充分反应:HCHO+2Ag(NH3)2++2O- $\stackrel{加热}{→}$ HCOO-+NH4++2Ag↓+H2O+3NH3 | |
| B. | 往苯酚钠溶液中通入少量二氧化碳气体: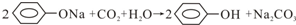 | |
| C. | 向盛有硫酸铜水溶液的试管里加入过量氨水:Cu2++4NH3•H2O═[Cu(NH3)4]2++4H2O | |
| D. | 溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+═AgBr↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 请回答下列问题.
请回答下列问题. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

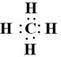 ,其空间构型为正四面体.
,其空间构型为正四面体.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和苯都能使溴水褪色,褪色的原因相同 | |
| B. | 聚乙烯可发生加成反应 | |
| C. | 乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别 | |
| D. | 蛋白质和油脂都属于高分子化合物,一定条件下都能水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16 种 | B. | 13 种 | C. | 10 | D. | 8 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
| PH | 8.3 | 8.4 | 8.5 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①③ | D. | ②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com