
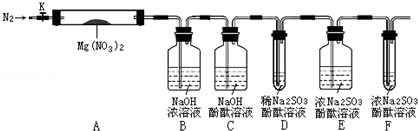
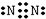 ,步骤Ⅱ中,通入一段时间N2的目的是避免对分解产物O2的检验产生干扰.
,步骤Ⅱ中,通入一段时间N2的目的是避免对分解产物O2的检验产生干扰.分析 ①根据氧化还原反应中化合价有升高,一定也要降低角度进行判断;
②氮气分子中含有氮氮三键,最外层满足8电子稳定结构;各装置中都有氧气,避免空气中氧气干扰实验;
③根据二氧化氮为红棕色气体分析;
④二氧化氮影响氧气的检验,所以检验氧气前先必须证明二氧化氮已经除尽;
⑤若C中红色溶液中有气泡冒出,D中溶液褪色,则证明产物中有氧气;分别写出亚硫酸钠水解、亚硫酸钠被氧气氧化的方程式;
⑥根据质量守恒进行判断;
⑦根据以上分析可知,硝酸镁分解生成氧化镁、二氧化氮和氧气,据此写出反应的方程式;
⑧空气中有氧气,能够将亚硫酸钠氧化成硫酸钠导致溶液质量增加.
解答 解:①Mg(NO3)2受热分解生成的氮化物中,N元素的化合价降低,则一定有化合价升高的元素,根据硝酸镁的组成可知,只能为-2价的氧元素失去电子生成氧气,
故答案为:N元素化合价降低,则一定存在化合价升高的元素,只能为氧元素失去电子生成O2;
②氮气分子中含有氮氮三键,氮原子最外层达到8电子稳定结构,其电子式为: ;
;
步骤Ⅱ中,通入一段时间N2,目的是用氮气排出装置中空气避免对产物氧气检验的干扰,
故答案为: ;避免对分解产物O2的检验产生干扰;
;避免对分解产物O2的检验产生干扰;
③步骤Ⅲ中,装置A内若出现了红棕色气体,则该红棕色气体为NO2,故答案为:NO2;
④装置D用于检验氧气,而二氧化氮能够氧化亚硫酸钠,影响了氧气的测定,所以必须用装置C验证NO2是否被吸收干净,防止NO2干扰后续对O2的检验,
故答案为:验证NO2是否被吸收干净,防止NO2干扰后续对O2的检验;
⑤若装置C中红色溶液中有气泡冒出,且试管D中亚硫酸钠的酚酞溶液褪色,则证明反应产物中有氧气,涉及的反应有:亚硫酸钠水解溶液呈碱性,所以滴有酚酞的溶液显示红色:Na2SO3+H2O?NaHSO3+NaOH、亚硫酸钠被氧化生成硫酸钠:2Na2SO3+O2=2Na2SO4,导致溶液褪色,
故答案为:C中红色溶液中有气泡冒出,D中溶液褪色;Na2SO3+H2O?NaHSO3+NaOH、2Na2SO3+O2=2Na2SO4;
⑥称取3.7gMg(NO3)2固体,反应后剩余1g固体,B中增重2.3g为二氧化氮质量,D、E增重的为氧气,质量为0.4g,总质量恰好为3.7g,说明反应产物中不会有氮气生成,
故答案为:Mg(NO3)2的质量与剩余固体、NO2、O2的质量之和相等,已符合质量守恒定律;
⑦取少量剩余固体于试管中,加入适量水,未出现明显现象,说明反应产物中没有氮化镁和亚硝酸镁,只能为氧化镁,结合其它分析可知,硝酸镁分解生成氧化镁、二氧化氮气体和氧气,反应方程式为:2Mg(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2MgO+4NO2↑+O2↑,
故答案为:2Mg(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2MgO+4NO2↑+O2↑;
⑧装置F的作用是吸收空气中氧气,避免干扰实验测定,由于亚硫酸钠与空气中氧气反应生成硫酸钠,导致试管F中溶液质量增加,
故答案为:吸收空气进入的O2所致.
点评 本题考查了性质实验方案的设计,题目难度中等,明确实验原理及化学实验基本操作方法为解答关键,注意掌握物质的性质及检验方法,试题侧重考查学生的分析、理解能力及化学实验能力.


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:解答题
 NH4+(2)
NH4+(2) H2O(3)
H2O(3) NH3
NH3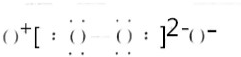 Na2O2(5)
Na2O2(5)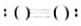 N2
N2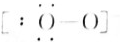 OH-(7)
OH-(7)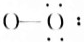 HF.
HF.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X为负极、Y为正极 | |
| B. | 工作一段时间后,KOH的物质的量不变 | |
| C. | 在标况下通过5.6 L O2完全反应则有l.0 mol 电子发生转移 | |
| D. | 该电池工作时甲烷一极附近溶液 pH降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④ | B. | ①②③ | C. | ③④⑤ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
时间/min n(CH4)/mol 温度 | 0 | 10 | 20 | 40 | 50 |
| T1 | 1.00 | 0.70 | 0.50 | 0.20 | 0.20 |
| T2 | 1.00 | 0.60 | 0.36 | … | 0.30 |
| A. | 10 min内,T1时的化学反应速率比T2时大 | |
| B. | 温度:T1<T2 | |
| C. | Q>0 | |
| D. | 化学平衡常数:K(T1)<K(T2) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①②③④ | C. | ①②③ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | Z | |
| A | NaHCO3溶液 | Na2CO3 | Ba(OH)2溶液 |
| B | Fe2O3 | Al2O3 | NaOH溶液 |
| C | FeCl3溶液 | CuCl2 | Fe |
| D | Na2SO4溶液 | Na2CO3 | 盐酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com