
分析 (1)依据配制溶液体积选择容量瓶规格,确定配制溶液体积,依据m=CVM计算需要氢氧化钠质量;
(2)依据配制溶液一般步骤选择需要仪器;
(3)容量瓶带有活塞,使用过程中需要上下颠倒,为防止漏水,使用前需要检查是否漏水;
(4)配制溶液一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等,据此排序;
(5)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析.
解答 解:(1)用固体烧碱配制0.1mol/L的NaOH溶液480mL,应选择500mL容量瓶,实际配制500mL溶液,需要氢氧化钠质量为:0.1mol/L×40g/mol×0.5L=2.0g;
故答案为:2.0;
(2)配制溶液一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等用到的仪器:托盘天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管,所以必须使用的仪器或用品:①烧杯②药匙③玻璃棒④电子天平,还缺少的仪器:500mL容量瓶、胶头滴管;
故答案为:①②③④;500mL容量瓶、胶头滴管;
(3)容量瓶带有活塞,使用过程中需要上下颠倒,为防止漏水,使用前需要检查是否漏水;
故答案为:查漏;
(4)配制溶液一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等,所以正确的步骤为:②①③⑤⑥⑦④;
故答案为:②①③⑤⑥⑦④;
(5)①未洗涤烧杯、玻璃棒,导致溶质部分损耗,溶质的物质的量偏小,溶液浓度偏低,故不选;
②NaOH溶液未冷却至室温就转移到容量瓶,冷却后溶液体积偏小,溶液浓度偏高,故选;
③容量瓶不干燥,含有少量蒸馏水,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变,故不选;
④称量NaOH的时间太长,导致氢氧化钠吸收空气中的水、二氧化碳,称取固体中含有氢氧化钠的物质的量偏小,溶液浓度偏低,故不选;
⑤定容时俯视刻度,导致溶液体积偏小,溶液浓度偏高,故选;
故选:②⑤.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理及操作步骤是解题关键,注意误差分析的方法和技巧,题目难度不大.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:多选题
| A. | 一定条件下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H<-38.6 kJ•mol-1 | |
| B. | 中和热的测定实验中需要用的主要玻璃仪器:两个大小相同的烧杯、两个大小相同的量筒、温度计、环形玻璃搅拌棒,也可以用保温杯代替烧杯做有关中和热测定的实验 | |
| C. | 在测定中和热的实验中,至少需要测定并记录的温度是3次 | |
| D. | CO(g)的燃烧热是283.0 kJ•mol-1,则CO2分解的热化学方程式为:2CO2(g)═2CO(g)+O2(g)△H=+283.0 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单斜硫转化为正交硫需要吸热 | B. | 单斜硫比正交硫稳定 | ||
| C. | △H4>△H5 | D. | △H4<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
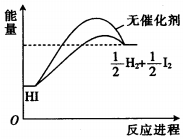
| A. | 加入催化剂,减小了反应的活化能 | |
| B. | 加入催化剂,可提高HI的平衡转化率 | |
| C. | 降低温度,HI的分解速率加快 | |
| D. | 反应物的总能量大于生成物的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在含有弱电解质的溶液中,往往有多个化学平衡共存.
在含有弱电解质的溶液中,往往有多个化学平衡共存.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 35 C1和37Cl | B. | CH3CH2CH2 CH3和CH (CH3)3 | ||
| C. | CH3CH3和CH3CH2CH3. | D. | H2O和H2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫化钠溶液加入稀硝酸:S2-+2H+═H2 S↑ | |
| B. | 用惰性电极电解饱和硫酸铜溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+ | |
| C. | NaHSO4溶液与Ba(OH)2溶液混合:HSO4-+Ba2++OH-═BaSO4↓+H2O | |
| D. | 在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4的离子方程式:3ClO-+2Fe(OH)3═2FeO42-+3Cl-+H2O+4H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com