
分析 (1)根据m=n•M计算质量,然后作比较;
(2)根据N=n•NA分子数目之比等于其物质的量之比;
(3)氧气含有氧原子为氧气分子2倍,臭氧含有氧原子数目为臭氧3倍,据此计算含有氧原子数目之比;
(4)根据V=n•Vm可知,相同条件下气体体积之比等于其物质的量之比.
解答 解:(1)根据m=n•M可知,0.3mol的氧气和0.2mol的臭氧(O3)的质量之比为:0.3mol×32g/mol:0.2mol×48g/mol=1:1,
故答案为:1:1;
(2)根据N=n•NA可知,二者含有分子数目之比为0.3mol:0.2mol=3:2,
故答案为:3:2;
(3)氧气含有氧原子为氧气分子2倍,臭氧含有氧原子数目为臭氧3倍,二者含有分子数目之比为3:2,含有氧原子数目之比为3×2:2×3=1:1,
故答案为:1:1;
(4)根据V=n•Vm可知,相同条件下气体体积之比等于其物质的量之比,故二者体积之比为0.3mol:0.2mol=3:2,
故答案为:3:2.
点评 本题考查物质的量有关计算,比较基础,难度不大,注意对公式的理解与灵活应用.


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:选择题
| A. | Cl2+H2O═HCl+HClO | B. | 2Na2O2+2H2O═4NaOH+O2↑ | ||
| C. | 2Na+2H2O═4NaOH+H2↑ | D. | 2H2O═2H2↑+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
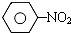 $\stackrel{Fe、HCl、H_{2}O}{→}$
$\stackrel{Fe、HCl、H_{2}O}{→}$
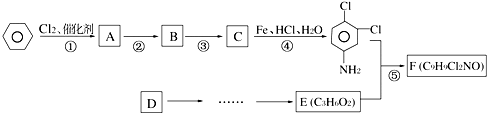
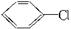 .反应②条件为浓硫酸加热.
.反应②条件为浓硫酸加热.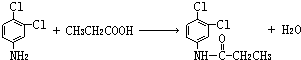 ;该反应的反应类型为取代反应.
;该反应的反应类型为取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合反应 | B. | 氧化还原反应 | C. | 置换反应 | D. | 分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | C-H | C-F | H-F | F-F |
| 键能 | 414 | 489 | 565 | 158 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室欲配制980mL0.100mol•L-1Na2CO3溶液,需要用到下列仪器:烧杯、量筒、药匙、玻璃棒、托盘天平
实验室欲配制980mL0.100mol•L-1Na2CO3溶液,需要用到下列仪器:烧杯、量筒、药匙、玻璃棒、托盘天平查看答案和解析>>
科目:高中化学 来源: 题型:填空题
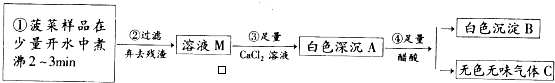
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
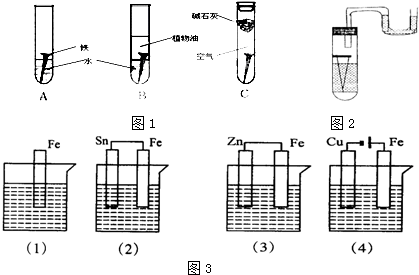
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com